Prostor kolem nás je naplněn různými fyzikálními těly, které se skládají z různých látek s různými hmotami. Školní kurzy chemie a fyziky, informující koncept a metodu hledání hmotnosti hmoty, poslouchal a bezpečně zapomněl na všechno, co šlo do školy. Mezitím však mohou být teoretické znalosti získané jednou nečekaný okamžik.
Výpočet hmotnosti látky za použití specifické hustoty látky. Příklad - Pro 200 litrů je barel. Musíte vyplnit barel jakékoliv kapaliny, řekněme, lehké pivo. Jak najít spoustu naplněných sudů? Použití receptury hustoty látky p \u003d m / v, kde p je specifická hustota látky, m - hmotnost, v - obsazený objem, aby bylo možné najít spoustu plného barrelu je velmi jednoduchý:- Objem objemu - Cubic Centimetr, metrů. To znamená, že hlaveň pro 200 litrů má objem 2 m³.
- Míra specifické hustoty je s pomocí tabulek a je konstantní hodnotou pro každou látku. Hustota se měří v kg / m³, g / cm³, t / m³. Hustota piva světla a jiných alkoholických nápojů lze zobrazit na webová stránka. Je to 1025,0 kg / m³.
- Z hustoty vzorce p \u003d m / v \u003d\u003e m \u003d p * V: m³ \u003d 1025,0 kg / m³ * 2 m³ \u003d 2050 kg.
Slavnostní objem 200 litrů, plně naplněných lehkým pivem, bude mít hodně 2050 kg.
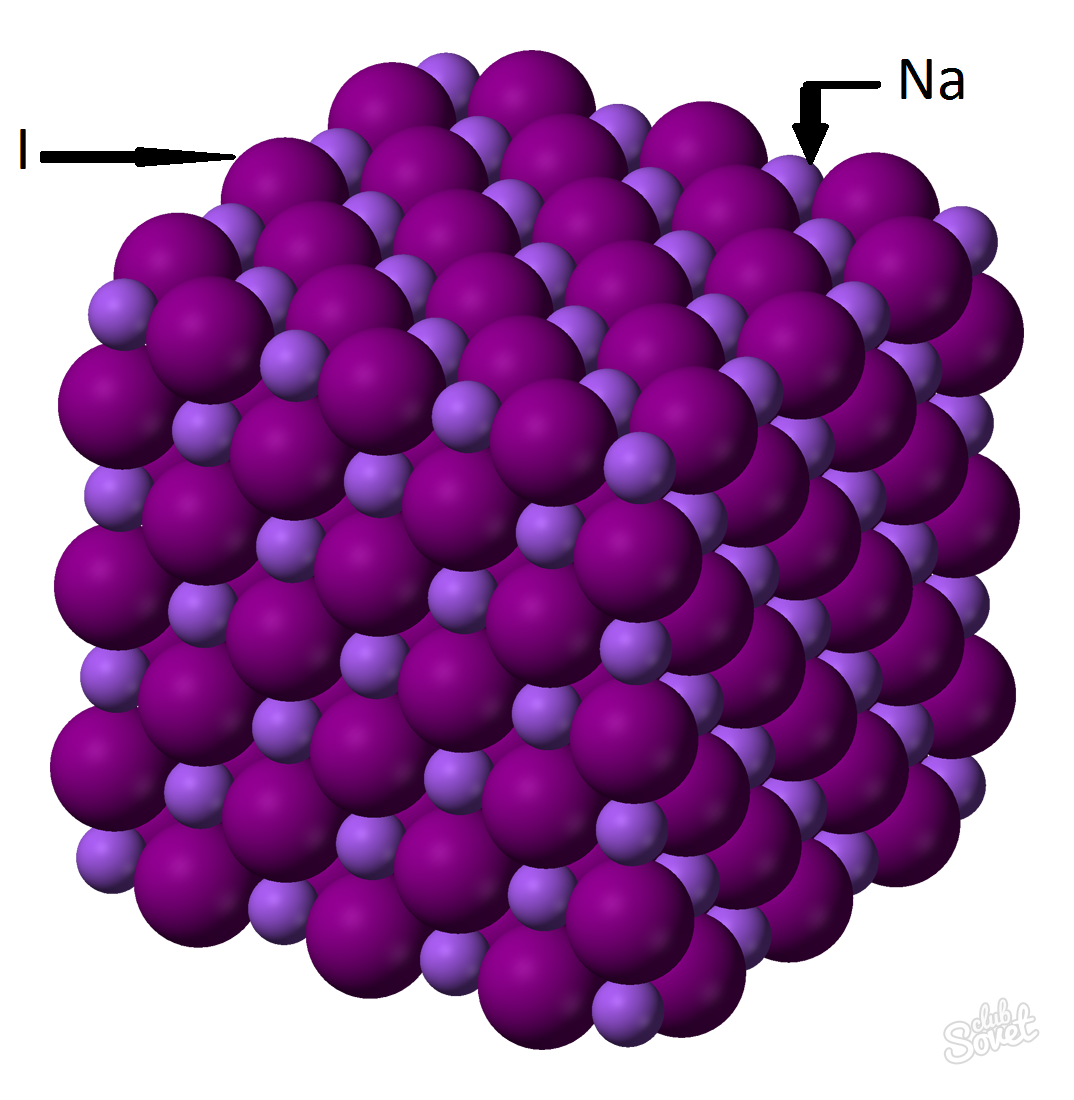
- Molární hmotnost se vypočítá v jednom měřicím systému S a měří se v kg / mol, g / mol. Molární hmotnost jodidu sodného je součet molárních hmot každého prvku: m (Nai) \u003d m (Na) + m (I). Hodnota molární hmotnosti každého prvku lze vypočítat na stole a můžete s pomocí online kalkulačky webová stránka: M (Nai) \u003d m (Na) + m (I) \u003d 23 + 127 \u003d 150 (g / mol).
- Obecného vzorce m (Nai) \u003d m (Nai) / V (Nai) \u003d\u003e m (Nai) \u003d V (NaI) * m (Nai) \u003d 0,6 mol * 150 g / mol \u003d 90 gramů.
Hmotnost jodidů sodné (NaI) s hmotnostní frakcí látky 0,6 mol je 90 gramů.
- Ředění vodním roztokem. Hmotnost rozpuštěné látky x nemění m (x) \u003d m '(x). Hmotnost roztoku se zvyšuje na hmotnost přidané vody m '(p) \u003d m (p) + m (h 2Ó).
- Odpařování vody z roztoku. Hmotnost rozpuštěné látky x nemění m (x) \u003d m '(x). Hmotnost roztoku se snižuje s hmotností odpařování vody m '(p) \u003d m (p) -m (h 2Ó).
- Bagr dvě řešení. Hromadná řešení, stejně jako hmotnost rozpuštěné látky X, směs se skládá: m '' (x) \u003d m (x) + m '(x). m '' (p) \u003d m (p) + m '(p).
- Ztráta krystalů. Hmotnosti rozpuštěné látky X a snížení roztoku na hmotnost krystalů klesly: m '(x) \u003d m (x) -m (sraženina), m' (p) \u003d m (p) -m (sraženina) .

Možnosti nalezení hmotnosti látky - odpojený průběh školního učení a metody plně aplikované v praxi. Každý může snadno najít hmotnost požadované látky, aplikovat výše uvedené vzorce a používat navrhované tabulky. Pro usnadnění úkolu předepište všechny reakce, jejich koeficienty.