Priestor okolo nás je naplnený rôznymi fyzickými telami, ktoré sa skladajú z rôznych látok s rôznymi hmotnosťami. Školské kurzy chémie a fyziky, informovanie koncepcie a spôsobu nájdenia hmoty hmoty, počúvali a bezpečne zabudli všetko, čo išlo do školy. Medzitým teoretické poznatky získané raz môžu byť potrebné na najneočenej chvíli.
Výpočet hmotnosti látky s použitím špecifickej hustoty látky. Príklad - existuje barel pre 200 litrov. Musíte naplniť hlaveň akéhokoľvek tekutiny, povedzme, ľahké pivo. Ako nájsť veľa naplnených sudov? Použitím hustotu Vzorec látky P \u003d m / V, kde p je špecifická hustota látky, M - hmotnosť, V - objem, na nájdenie mnohých úplných barel je veľmi jednoduché:- Objemy objemu - kubické centimetre, merače. To znamená, že hlaveň pre 200 litrov má objem 2 m³.
- Meranie špecifickej hustoty je s pomocou tabuliek a je konštantnou hodnotou pre každú látku. Hustota sa meria v kg / m³, g / cm³, t / m³. Hustota piva svetla a iných alkoholických nápojov je možné vidieť na internetová stránka. Je to 1025,0 kg / m³.
- Z firmy hustotu p \u003d m / v \u003d\u003e m \u003d p * v: m³ \u003d 1025,0 kg / m³ * 2 m³ \u003d 2050 kg.
Objem barel 200 litrov, plne naplnený ľahkými pivom, bude mať veľa 2050 kg.
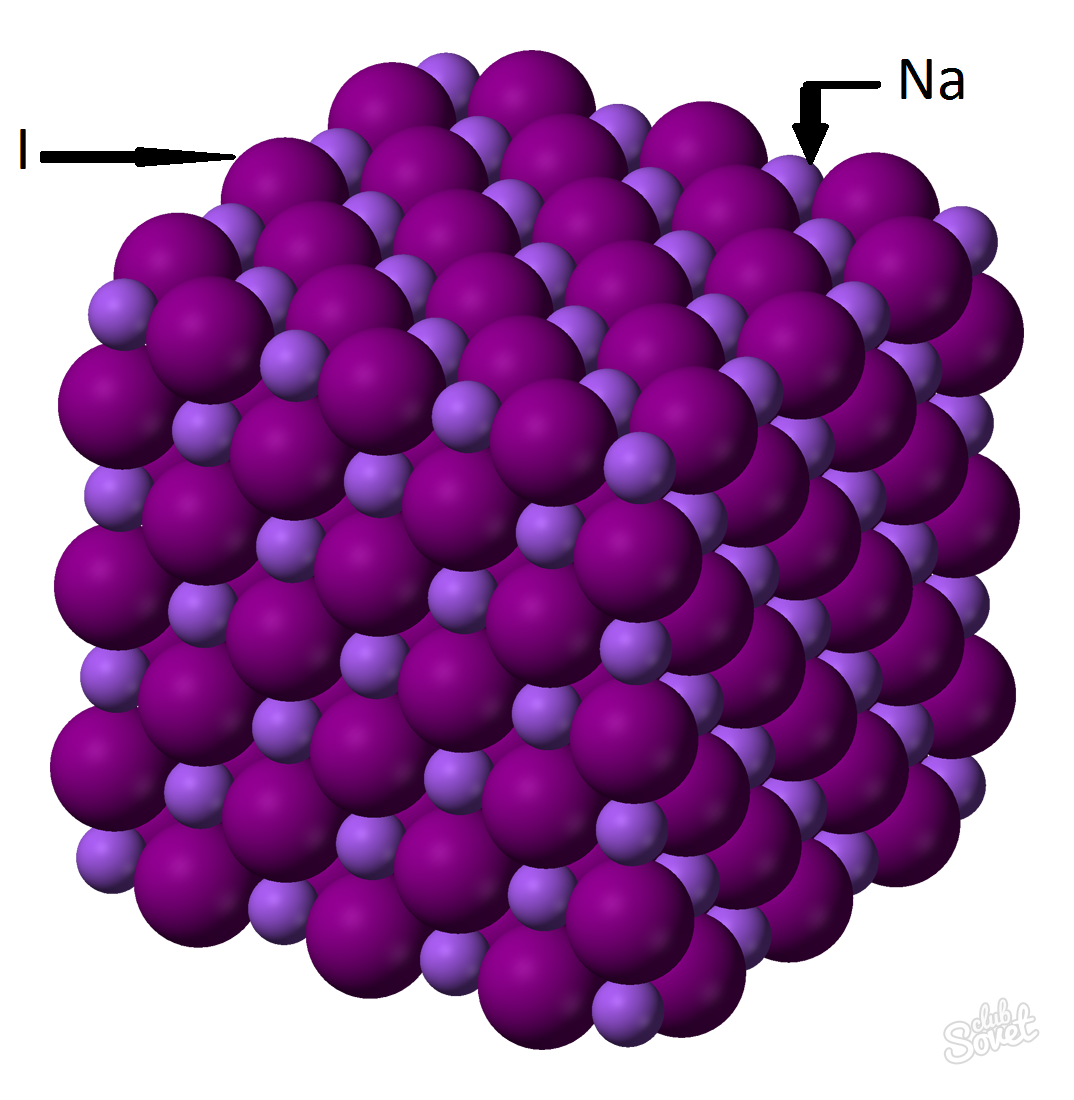
- Molárna hmotnosť sa vypočíta v jednom meracom systéme S a meria sa v kg / mol, g / mol. Molárna hmotnosť jodidu sodného je súčtom molárnych hmotností každého prvku: m (nai) \u003d m (NA) + m (I). Hodnota molárnej hmotnosti každého prvku môže byť vypočítaná na stole a môžete s pomocou online kalkulačky internetová stránka: M (nai) \u003d m (Na) + m (I) \u003d 23 + 127 \u003d 150 (g / mol).
- Všeobecného vzorca M (Nai) \u003d M (Nai) / V (Nai) \u003d\u003e M (Nai) \u003d V (Nai) * m (Nai) \u003d 0,6 mol * 150 g / mol \u003d 90 gramov.
Hmotnosť jodid sodný (NaI) s hmotnostnou frakciou látky 0,6 mol je 90 gramov.
- Riešenie vodou. Hmotnosť rozpustenej látky X sa nezmení m (x) \u003d m '(x). Hmotnosť roztoku sa zvyšuje na hmote pridanej vody m '(p) \u003d m (p) + m (H 2O).
- Odparenie vody z roztoku. Hmotnosť rozpustenej látky x sa nezmení m (x) \u003d m '(x). Hmota roztoku sa znižuje s hmotnosťou odparovania vody M '(p) \u003d m (p) -M (H 2O).
- Dva riešenia. Hmotnostné roztoky, ako aj hmotnosť rozpustenej látky X sa zmes zloží: m '' (x) \u003d m (x) + m '(x). m '' (p) \u003d m (p) + m '(p).
- Strata kryštálov. Masí rozpustenej látky X a roztok sa znižujú na hmote kryštálov spadol: M '(x) \u003d m (x) -M (zrazenina), m' (p) \u003d m (p) -M (zrazenina) .

Zisťovanie možností hmotu látky - odpojenej priebeh školského vzdelávania, ako aj metódy plne uplatniť v praxi. Každý si môže ľahko nájsť množstvo požadovanej látky, použitie uvedených vzorcov a využitím navrhovaných tabuliek. S cieľom uľahčiť úlohu, predpísať všetky reakcie, ich koeficienty.