O espaço ao nosso redor é preenchido com diferentes corpos físicos, que consistem em substâncias diferentes com diferentes massas. Cursos escolares de química e física, informando o conceito e o método de encontrar uma massa de matéria, escutados e esquecidos com segurança tudo o que foi para a escola. Mas enquanto isso, o conhecimento teórico adquirido pela primeira vez pode ser necessário no momento mais inesperado.
Calcular a massa da substância usando a densidade específica da substância. Um exemplo - há um barril para 200 litros. Você precisa preencher o barril de qualquer líquido, digamos, cerveja leve. Como encontrar muitos barris cheios? Usando a fórmula de densidade da substância p \u003d m / v, onde p é a densidade específica da substância, m - massa, V - volume ocupado, para encontrar um monte de barril completo é muito simples:- Volumes de volume - centímetros cúbicos, metros. Ou seja, o barril para 200 litros tem um volume de 2 m³.
- A medida da densidade específica é com a ajuda das tabelas e é um valor constante para cada substância. A densidade é medida em kg / m³, g / cm³, t / m³. A densidade da cerveja de luz e outras bebidas alcoólicas pode ser vista sobre local na rede Internet. É 1025.0 kg / m³.
- A partir da fórmula de densidade p \u003d m / v \u003d\u003e m \u003d p * v: m³ \u003d 1025,0 kg / m³ * 2 m³ \u003d 2050 kg.
O volume de barril de 200 litros, totalmente preenchido com cerveja leve, terá muitos 2050 kg.
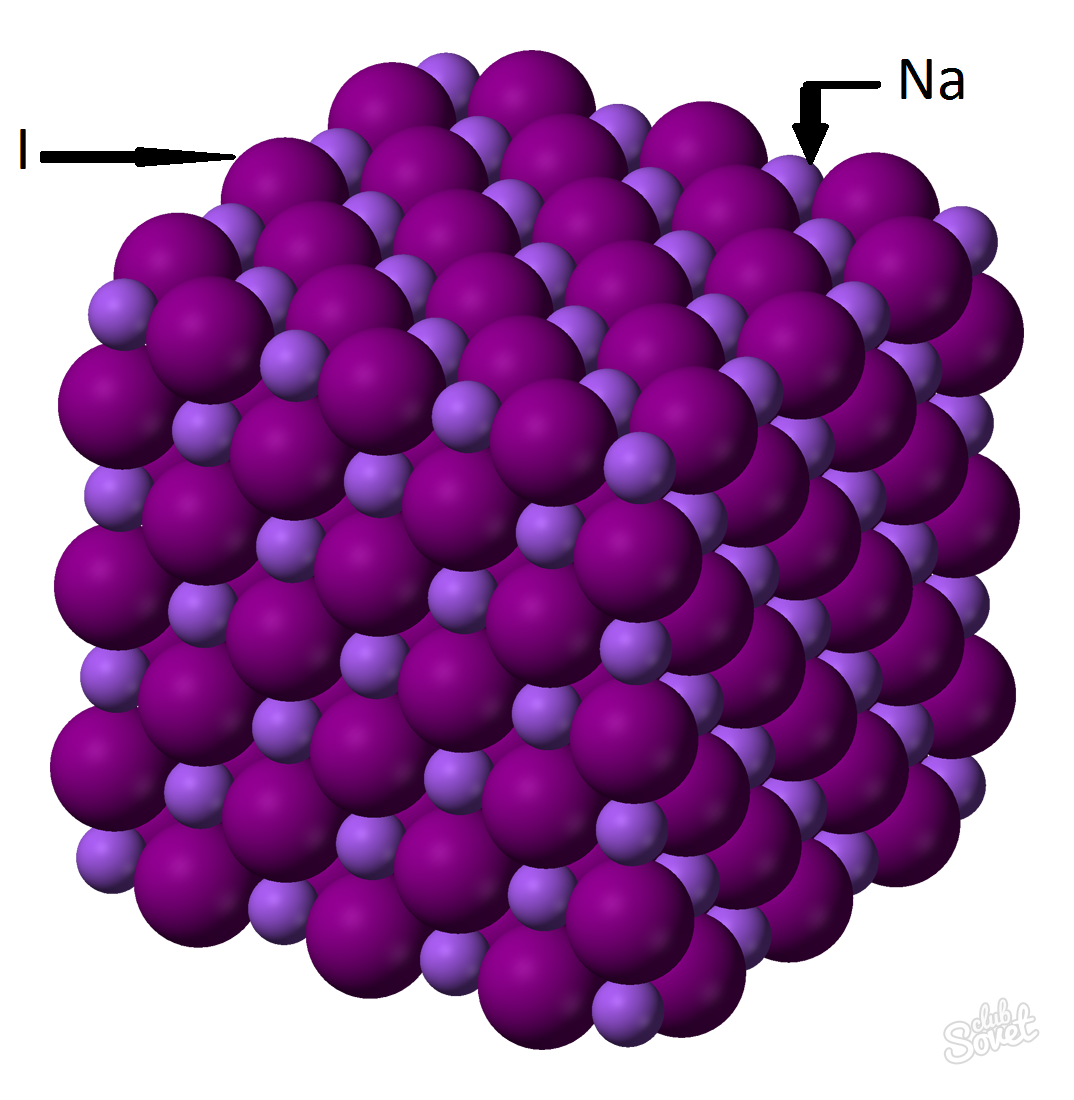
- A massa molar é calculada em um único sistema de medição e é medida em kg / mol, g / mol. A massa molar de iodeto de sódio é a soma das massas molares de cada elemento: m (NAI) \u003d m (na) + m (i). O valor da massa molar de cada elemento pode ser calculado na tabela, e você pode com a ajuda de uma calculadora on-line em local na rede Internet: M (nai) \u003d m (na) + m (i) \u003d 23 + 127 \u003d 150 (g / mol).
- Da Fórmula Geral M (NAI) \u003d M (NAI) / V (NAI) \u003d\u003e M (NAI) \u003d V (NAI) * M (NAI) \u003d 0,6 mol * 150 g / mol \u003d 90 gramas.
A massa de iodeto de sódio (NAI) com uma fração de massa de uma substância de 0,6 mol é 90 gramas.
- Diluição com solução de água. A massa da substância X dissolvida não altera M (x) \u003d m '(x). A massa da solução aumenta na massa da água adicionada m '(p) \u003d m (p) + m (h 2O).
- Evaporação da água da solução. A massa da substância dissolvida x não muda m (x) \u003d m '(x). A massa da solução diminui para a massa da evaporação da água m '(p) \u003d m (p) -m (h 2O).
- Digger duas soluções. Soluções de massa, bem como a massa da substância dissolvida x, a mistura é dobrada: m '' (x) \u003d m (x) + m '(x). m '' (p) \u003d m (p) + m '(p).
- Perda de cristais. As massas da substância dissolvida X e a solução diminuem na massa dos cristais caíram: m '(x) \u003d m (x) -m (precipitado), m' (p) -m (p) -m (precipitado) .

Opções encontrando uma massa de uma substância - um curso desconectado de aprendizagem escolar e os métodos totalmente aplicados na prática. Todos podem facilmente encontrar uma massa da substância necessária, aplicando as fórmulas acima e usando as tabelas propostas. Para facilitar a tarefa, prescrever todas as reações, seus coeficientes.