Ο χώρος γύρω μας γεμίζεται με διαφορετικά φυσικά σώματα, τα οποία αποτελούνται από διαφορετικές ουσίες με διαφορετικές μάζες. Σχολικά μαθήματα χημείας και φυσικής, ενημέρωση της έννοιας και της μεθόδου για την εξεύρεση μίας μάζας ύλης, ακούγονται και ξεχασμένα όλα όσα πήγαν στο σχολείο. Εν τω μεταξύ, οι θεωρητικές γνώσεις που αποκτήθηκαν με μία φορά μπορεί να χρειαστούν κατά την πιο απροσδόκητη στιγμή.
Υπολογισμός της μάζας της ουσίας χρησιμοποιώντας τη συγκεκριμένη πυκνότητα της ουσίας. Ένα παράδειγμα - υπάρχει ένα βαρέλι για 200 λίτρα. Πρέπει να γεμίσετε το βαρέλι οποιουδήποτε υγρού, να πείτε, ελαφριά μπύρα. Πώς να βρείτε πολλά γεμάτα βαρέλια; Χρησιμοποιώντας τον τύπο πυκνότητας της ουσίας p \u003d m / V, όπου το p είναι η ειδική πυκνότητα της ουσίας, μάζα, μάζα, ο όγκος του V, για να βρείτε πολλά πλήρη βαρέλι είναι πολύ απλή:- Τόμους όγκου - κυβικά εκατοστά, μέτρα. Δηλαδή, το βαρέλι για 200 λίτρα έχει όγκο 2 m³.
- Το μέτρο ειδικής πυκνότητας είναι με τη βοήθεια πινάκων και είναι μια σταθερή τιμή για κάθε ουσία. Η πυκνότητα μετράται σε kg / m³, g / cm3, t / m³. Η πυκνότητα της μπύρας του φωτός και άλλων αλκοολούχων ποτών μπορεί να προβληθεί δικτυακός τόπος. Είναι 1025,0 kg / m³.
- Από τον τύπο πυκνότητας P \u003d m / V \u003d\u003e m \u003d p * V: m³ \u003d 1025,0 kg / m³ * 2 m³ \u003d 2050 kg.
Ο όγκος Barrel των 200 λίτρων, πλήρως γεμάτος με ελαφριά μπύρα, θα έχει πολλά 2050 κιλά.
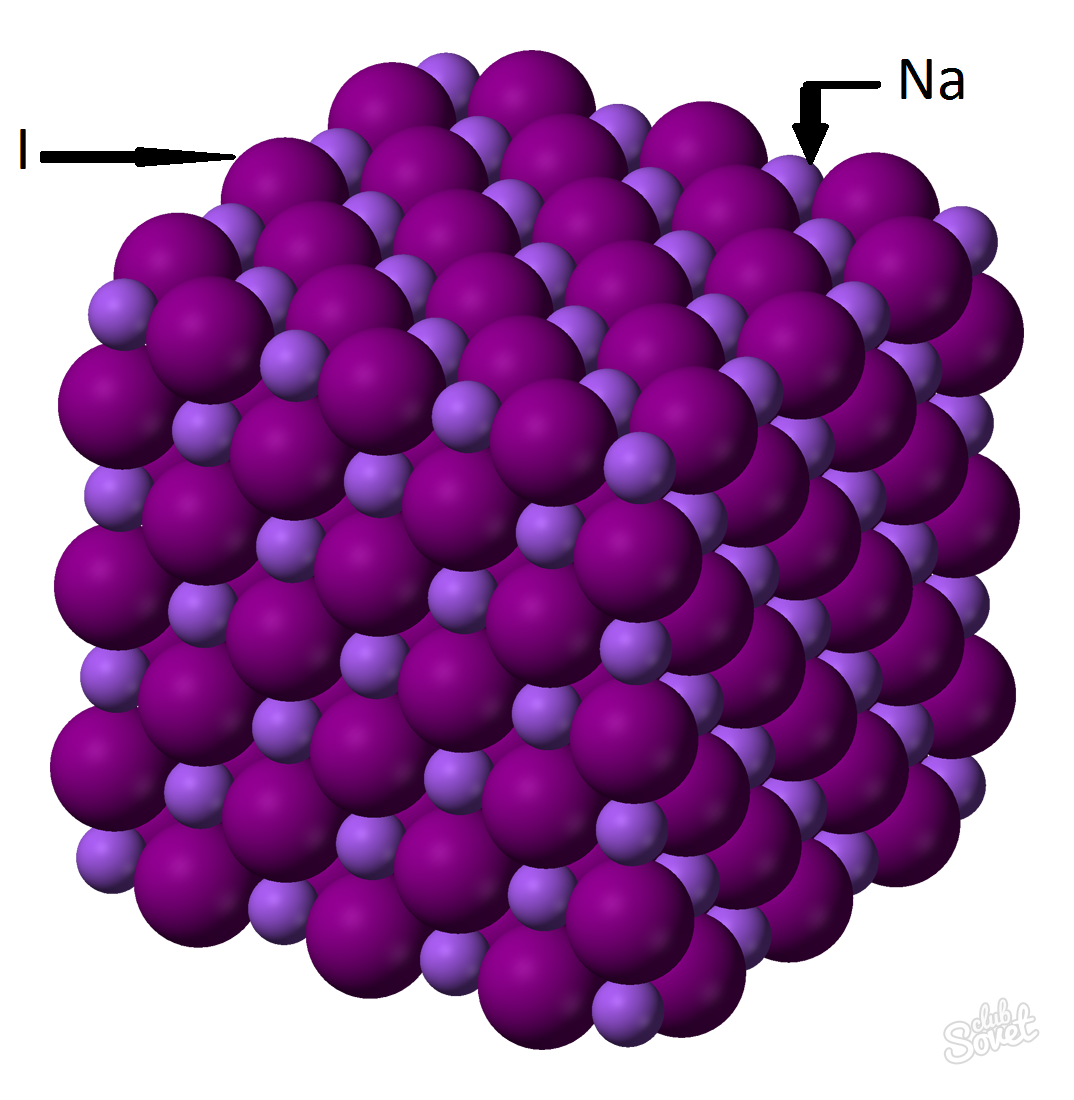
- Η μοριακή μάζα υπολογίζεται σε ένα μόνο σύστημα μέτρησης S και μετράται σε kg / mol, g / mol. Η μοριακή μάζα του ιωδιούχου νατρίου είναι το άθροισμα των γραμμομοριακών μάζων κάθε στοιχείου: m (nai) \u003d m (na) + m (i). Η τιμή της γραμμομοριακής μάζας κάθε στοιχείου μπορεί να υπολογιστεί στον πίνακα και μπορείτε να κάνετε τη βοήθεια μιας ηλεκτρονικής αριθμομηχανής δικτυακός τόπος: M (nai) \u003d m (na) + m (i) \u003d 23 + 127 \u003d 150 (g / mol).
- Του γενικού τύπου M (nai) \u003d m (nai) / v (nai) \u003d\u003e m (nai) \u003d v (nai) * m (nai) \u003d 0,6 mol * 150 g / mol \u003d 90 γραμμάρια.
Μάζα ιωδιούχου νατρίου (NaI) με ένα κλάσμα μάζας μιας ουσίας 0,6 mol είναι 90 γραμμάρια.
- Αραίωση με διάλυμα νερού. Η μάζα της διαλελυμένης ουσίας x δεν αλλάζει m (x) \u003d m '(x). Η μάζα του διαλύματος αυξάνεται στη μάζα του προστιθέμενου νερού m '(p) \u003d m (p) + m (h 2O).
- Εξάτμιση νερού από τη λύση. Η μάζα της διαλυμένης ουσίας Χ δεν αλλάζει m (x) \u003d m '(x). Η μάζα της λύσης μειώνεται στη μάζα της εξάτμισης του νερού m '(p) \u003d m (p) -m (h 2O).
- Digger δύο λύσεις. Τα μαζικά διαλύματα, καθώς και η μάζα της διαλυμένης ουσίας Χ, το μίγμα διπλώνεται: m '' (x) \u003d m (x) + m '(x). m '' (p) \u003d m (p) + m '(p).
- Απώλεια κρυστάλλων. Οι μάζες της διαλυμένης ουσίας Χ και η μείωση του διαλύματος στη μάζα των κρυστάλλων μειώθηκε: m '(x) \u003d m (x) -m (ίζημα), m' (p) \u003d m (p) -m (ίζημα) .

Επιλογές που βρίσκουν μάζα μιας ουσίας - μια αποσυνδεδεμένη πορεία της σχολικής μάθησης και οι μέθοδοι εφαρμόζονται πλήρως στην πράξη. Όλοι μπορούν εύκολα να βρουν μια μάζα της απαιτούμενης ουσίας, εφαρμόζοντας τους παραπάνω τύπους και χρησιμοποιώντας τους προτεινόμενους πίνακες. Για να διευκολυνθεί η εργασία, ορίστε όλες τις αντιδράσεις, τους συντελεστές τους.