Utrymmet runt oss är fyllt med olika fysiska kroppar, som består av olika ämnen med olika massor. Skolkurser av kemi och fysik, som informerar konceptet och metoden att hitta en massa materia, lyssnade och säkert glömt allt som gick till skolan. Men under tiden kan den teoretiska kunskapen som förvärvats av en gång behövas vid det mest oväntade ögonblicket.
Beräkning av ämnets massa med användning av substansens specifika densitet. Ett exempel - det finns ett fat i 200 liter. Du måste fylla fatet av någon vätska, säg, lätt öl. Hur man hittar många fyllda fat? Användning av densitetsformeln för ämnet P \u003d m / v, där p är substansens specifika densitet, m-massa, v-ockuperad volym, för att hitta mycket fullt fat är mycket enkelt:- Volymer av volym - kubikcentimeter, meter. Det vill säga, tunnan i 200 liter har en volym på 2 m³.
- Måttet på specifik densitet är med hjälp av tabeller och är ett konstant värde för varje ämne. Tätheten mäts i kg / m³, g / cm3, t / m³. Tätheten av ljuset av ljus och andra alkoholhaltiga drycker kan ses på hemsida. Det är 1025,0 kg / m³.
- Från densitetsformeln p \u003d m / v \u003d\u003e m \u003d p * v: m³ \u003d 1025,0 kg / m³ * 2 m³ \u003d 2050 kg.
Fatvolymen av 200 liter, fullt fylld med lätt öl, kommer att ha mycket 2050 kg.
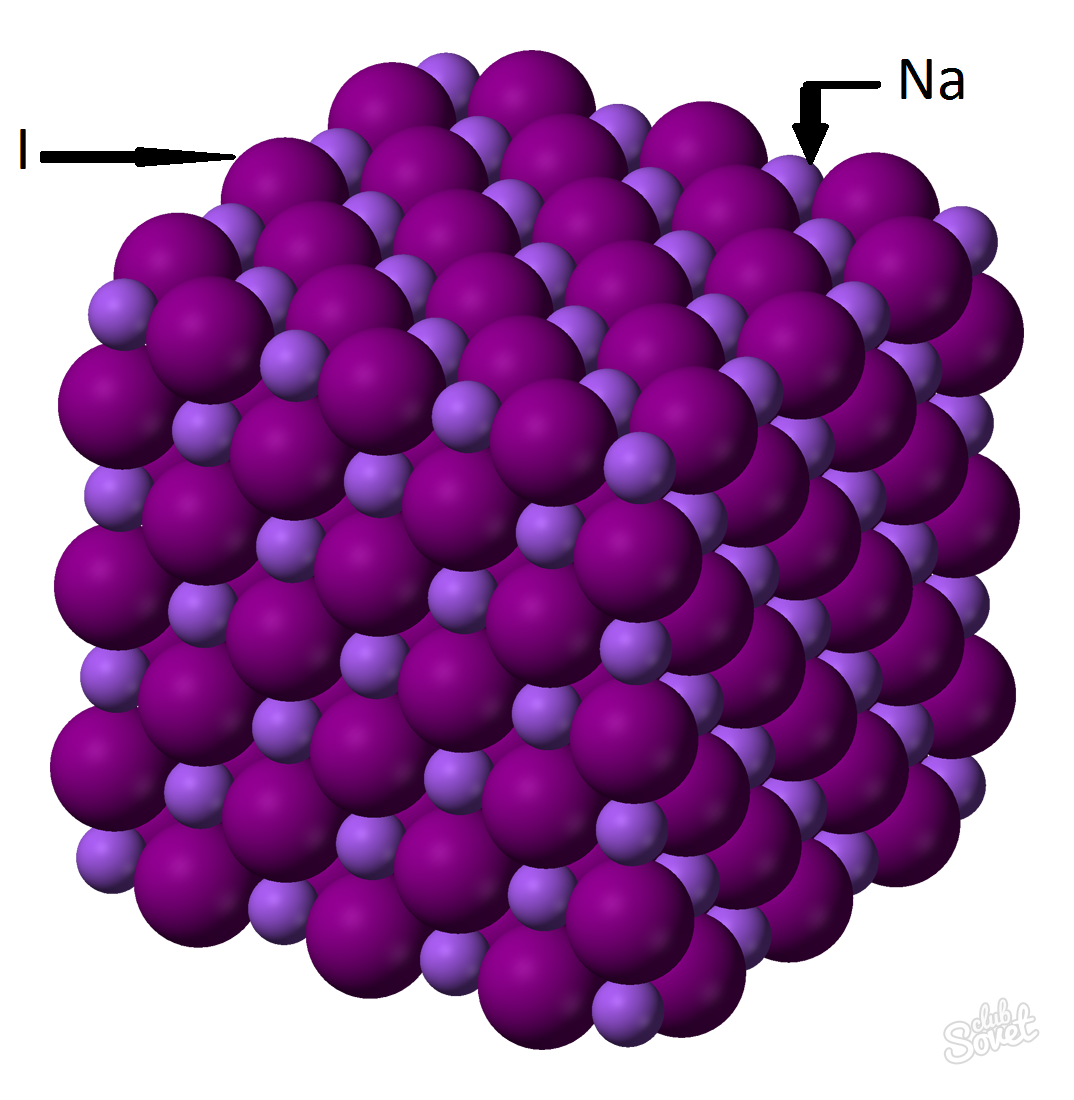
- Den molära massan beräknas i ett enda mätsystem S och mäts i kg / mol, g / mol. Den molära massan av natriumjodid är summan av de molära massorna hos varje element: M (Nai) \u003d M (Na) + M (I). Värdet på den molära massan hos varje element kan beräknas på bordet, och du kan med hjälp av en online-kalkylator på hemsida: M (nai) \u003d m (na) + m (i) \u003d 23 + 127 \u003d 150 (g / mol).
- Av den allmänna formeln M (Nai) \u003d m (Nai) / v (nai) \u003d\u003e M (Nai) \u003d V (Nai) * m (nai) \u003d 0,6 mol * 150 g / mol \u003d 90 gram.
Natriumjodidmassa (Nai) med en massfraktion av ett ämne av 0,6 mol är 90 gram.
- Utspädning med vattenlösning. Massan av det upplösta X-ämnet ändras inte m (x) \u003d m '(x). Massan av lösningen ökar på massan av det tillsatta vattnet M '(P) \u003d M (P) + M (H 2O).
- Vattenindunstning från lösningen. Massan av det upplösta ämnet X ändras inte M (X) \u003d M '(x). Massan av lösningen minskar till massan av avdunstningen av vattnet M '(P) \u003d M (P) -M (H 2O).
- Digger två lösningar. Masslösningar, liksom massan av den upplösta substansen X, blandas blandningen: M '' (x) \u003d m (x) + m '(x). m '' (p) \u003d m (p) + m '(p).
- Förlust av kristaller. Massorna av den upplösta substansen X och lösningen minskar på kristallens massa tappade: M '(x) \u003d m (x) -m (fällning), m' (p) \u003d m (p) -m (fällning) .

Alternativ som hittar en massa av ett ämne - en urkopplad kurs av skolinlärning, och de metoder som är fullt tillämpade i praktiken. Alla kan enkelt hitta en massa av det önskade ämnet, som tillämpar ovanstående formler och med de föreslagna tabellerna. För att underlätta uppgiften, förskriva alla reaktioner, deras koefficienter.