Przestrzeń wokół nas jest wypełniona różnymi ciałami fizycznymi, które składają się z różnych substancji z różnymi masami. Kursy szkolne chemii i fizyki, informując koncepcję i metodę znalezienia masy materii, słuchali i bezpiecznie zapomniały wszystko, co poszło do szkoły. Ale tymczasem wiedza teoretyczna nabyta przez raz może być potrzebna w najbardziej nieoczekiwanym momencie.
Obliczanie masy substancji za pomocą określonej gęstości substancji. Przykładem - jest lufa na 200 litrów. Musisz wypełnić lufę dowolnej płynu, powiedzmy, lekkie piwo. Jak znaleźć wiele wypełnionych baryłek? Korzystanie z formuły gęstości substancji p \u003d m / v, gdzie p jest specyficzną gęstością substancji, m - Mass, V - zajętej objętości, aby znaleźć wiele pełnej lufy, jest bardzo proste:- Woluminy objętości - centymetry sześcienne, metry. Oznacza to, że lufa na 200 litrów ma objętość 2 m³.
- Miara określonej gęstości jest przy pomocy tabel i jest stałą wartością dla każdej substancji. Gęstość mierzona jest w kg / m³, g / cm³, t / m³. Gęstość piwa światła i innych napojów alkoholowych można oglądać strona internetowa. Jest 1025,0 kg / m³.
- Od formuły gęstości p \u003d m / v \u003d\u003e m \u003d p * V: m³ \u003d 1025,0 kg / m³ * 2 m³ \u003d 2050 kg.
Objętość lufy 200 litrów, całkowicie wypełniona lekkim piwem, będzie miało dużo 2050 kg.
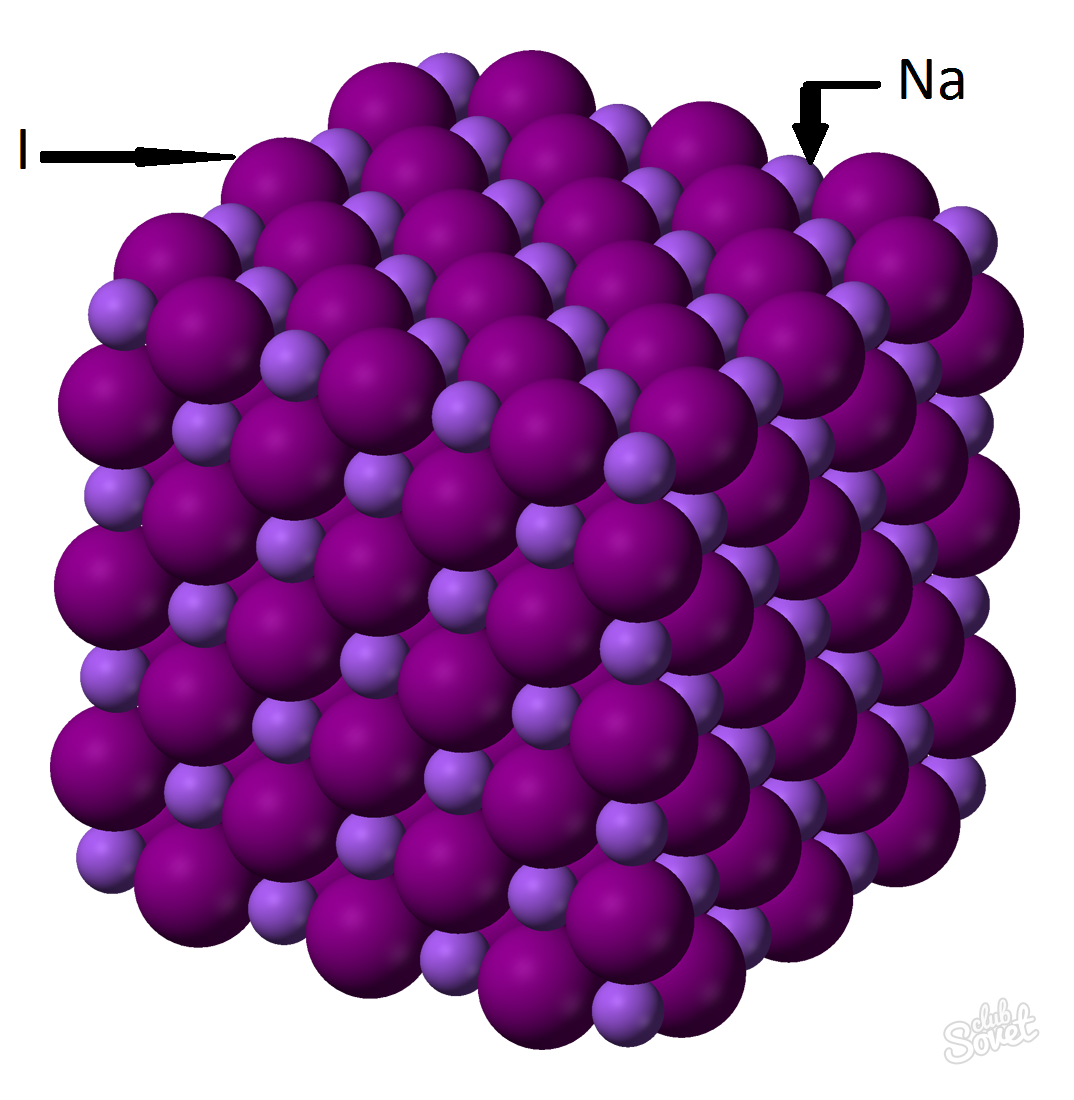
- Masa molowa jest obliczana w jednym układzie pomiarowym S i jest mierzona w kg / mol g / mol. Masa cząsteczkowa jodku sodu jest sumą mas cząsteczkowych w każdym elemencie M (NAI) \u003d M (Na) + m (I). Wartość masy molowej każdego elementu może być obliczona na stole i można z pomocą Kalkulatora na strona internetowaM (NAI) \u003d M (Na) + m (I) \u003d 23 + 127 \u003d 150 (g / mol).
- O wzorze ogólnym M (NAI) \u003d M (NAI) / V (NAI) \u003d\u003e M (NAI) \u003d V (NAI) * K (NAI) \u003d 0,6 mola x 150 g / mol \u003d 90 gramów.
Masa jodek sodu (NAI) o stosunku wagowym substancji 0,6 mol wynosi 90 gramów.
- Po rozcieńczeniu wodnym roztworem. Masa substancji rozpuszczonej X nie zmienia m (x) \u003d M „(x). Masę roztworu wzrasta na masę dodanej wody M „(p) \u003d m (p) + m (H 2O).
- Po odparowaniu wody z roztworu. Masa rozpuszczonej substancji X nie zmienia m (x) \u003d M „(x). Masa roztworu zmniejsza się do masy po odparowaniu wody M „(p) \u003d m (p) -m (h 2O).
- Koparko dwa rozwiązania. Roztwory masy, jak również masa substancji rozpuszczonej X, mieszanina jest złożona: M '' (x) \u003d m (x) + M „(x). M '' (t) \u003d m (p) + m „(P).
- Utrata kryształów. Masy rozpuszczonej substancji X i zmniejszenie roztworu na masy kryształów spadła M '(x) \u003d m (x) -m (osad), m' (P) \u003d m (p) -m (osad) ,

Opcje znalezienia masy substancji - odłączony przebieg nauki szkolnej, a metody w pełni stosowane w praktyce. Każdy może łatwo znaleźć masę wymaganej substancji, stosując powyższe wzory i stosując proponowane tabele. Aby ułatwić zadanie, przepisać wszystkie reakcje, ich współczynniki.