El espacio que nos rodea está lleno de diferentes cuerpos físicos, que constan de diferentes sustancias con diferentes masas. cursos de la escuela de química y física, informando al concepto y método de búsqueda de la masa de la materia, escucharon y se olvidan con seguridad todo lo que estudió en la escuela. Pero mientras tanto los conocimientos teóricos adquiridos por una vez puede ser necesaria en el momento más inesperado.
Cálculo de la masa de la sustancia utilizando la densidad específica de la sustancia. Un ejemplo - hay un barril de 200 litros. Es necesario rellenar el cañón hay, por ejemplo, la cerveza ligera líquido. ¿Cómo encontrar una gran cantidad de barriles llenos? Utilizando la fórmula de densidad P \u003d M / V, donde P es la densidad específica de la sustancia, M - masa, V - volumen ocupado, de encontrar una gran cantidad de lleno el barril es muy simple:- Los métodos de volúmenes - centímetros cúbicos, metros. Esto es, el barril de 200 litros tiene un volumen de 2 m³.
- La medida de la densidad específica es con la ayuda de tablas y es un valor constante para cada sustancia. La densidad se mide en kg / m³, g / cm³, t / m³. La densidad de la cerveza de bebidas alcohólicas de luz y otros se puede ver en sitio.. Es 1025.0 kg / m³.
- De la fórmula de densidad p \u003d m / v \u003d\u003e m \u003d p * v: m $ ³ $ \u003d 1025.0 kg / m³ * 2 m³ \u003d 2050 kg.
volumen barril de 200 litros, totalmente llenos de cerveza ligera, tendrá una gran cantidad de 2050 kg.
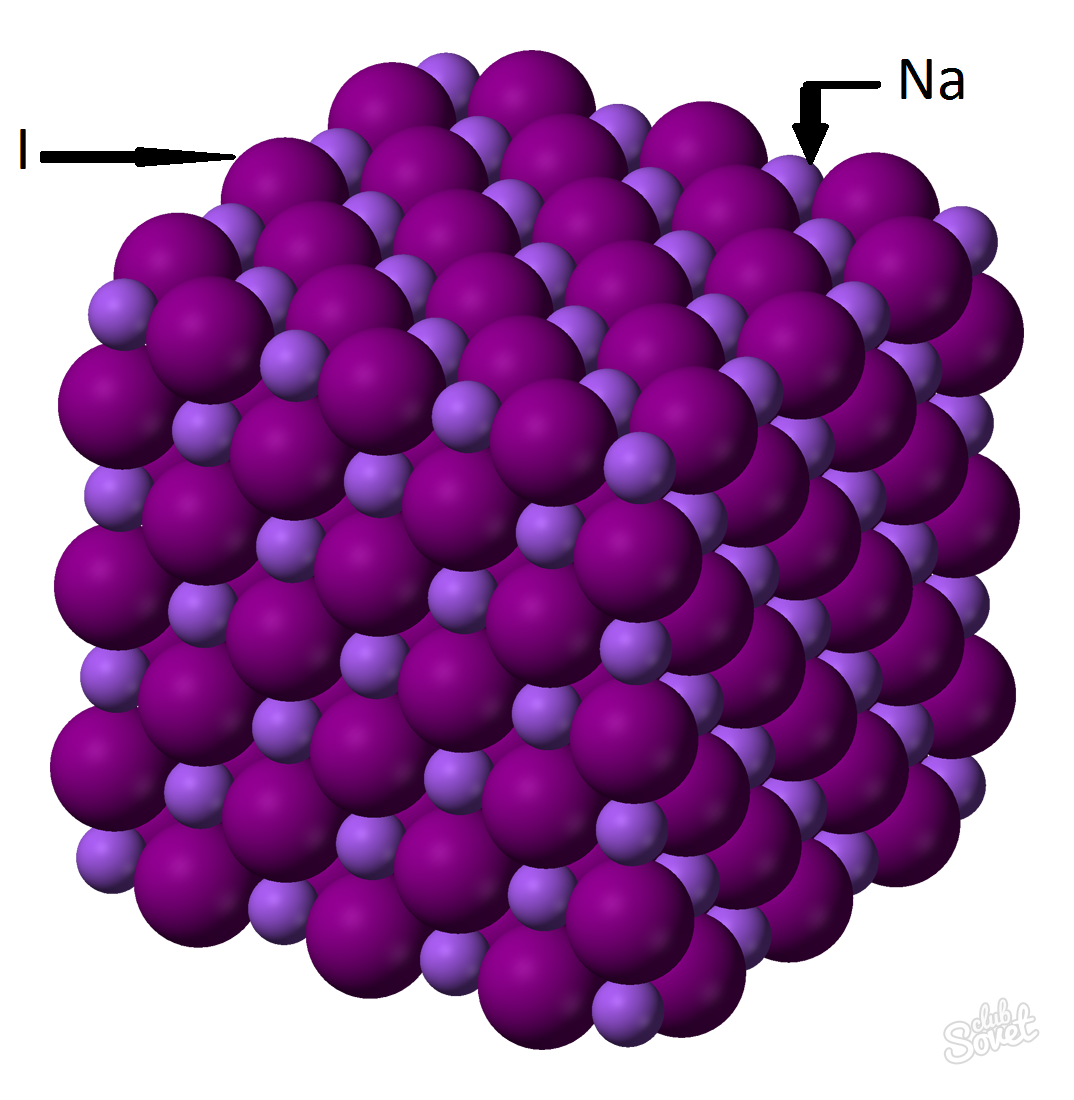
- La masa molar se calcula en un único sistema de medición S y se mide en kg / mol, g / mol. La masa molar de yoduro de sodio es la suma de las masas molares de cada elemento: M (NAI) \u003d m (na) + m (i). El valor de la masa molar de cada elemento puede ser calculada por la mesa, y puede estar utilizando una calculadora en línea en sitio.: M (NAI) \u003d M (Na) + m (i) \u003d 23 + 127 \u003d 150 (g / mol).
- De la fórmula general M (NAI) \u003d M (NAI) / V (NAI) \u003d\u003e M (NAI) \u003d V (NAI) * M (NAI) \u003d 0,6 mol * 150 g / mol \u003d 90 gramos.
masa yoduro de sodio (NAI) con una fracción de masa de una sustancia de 0,6 mol es de 90 gramos.
- La dilución de la solución de agua. La masa de la sustancia disuelta x no cambia m (x) \u003d m '(x). La masa de la solución aumenta en la masa de agua M añadido '(p) \u003d m (p) + m (H 2O).
- La evaporación del agua de la solución. La masa de la sustancia X disuelto no cambia m (x) \u003d m '(x). La masa de la solución disminuye a la masa de la evaporación del agua M '(p) \u003d m (p) -m (H 2O).
- Excavadora dos soluciones. Las masas de soluciones, así como la masa de la sustancia disuelta x, se pliegan con la mezcla de: M '' (x) \u003d m (x) + m '(x). M '' (p) \u003d m (p) + m '(p).
- La pérdida de cristales. Las masas de la sustancia X disuelto y la disminución solución a la masa de los cristales cayeron: M '(x) \u003d m (x) -m (precipitado), M' (p) \u003d m (p) -m (precipitado) .

Búsqueda de opciones de una masa de una sustancia - un curso desconectados del aprendizaje escolar, y los métodos aplicados plenamente en la práctica. Todo el mundo puede encontrar fácilmente una masa de la sustancia requerida, aplicando las fórmulas anteriores y utilizar las mesas propuestas. Para facilitar la tarea, prescribir todas las reacciones, sus coeficientes.