Пространството около нас е изпълнен с различни физически тела, които се състоят от различни вещества с различни маси. Училищни курсове на химията и физиката, информиране на концепцията и начина на намиране на маса на материята, слушат и безопасно забравени всичко, което е ходил на училище. Но междувременно теоретичните знания, придобити от веднъж може да са необходими в най-неочакван момент.
Изчисляване на маса на веществото с помощта на специфичната плътност на веществото. Един пример - има за барел за 200 литра. Необходимо е да попълните цевта на течността, да речем, светла бира. Как да намерите много пълни бъчви? Използване формула плътност на вещество Р \u003d M / V, където Р е специфичната плътност на веществото, М - маса, V - заетия обем, да се намери много пълен цилиндър е много проста:- Обемите на обем - кубически сантиметра, м. Това означава, че цевта на 200 литра е с обем 2 m³.
- Мярката на специфична плътност е с помощта на таблици и е постоянна величина за всяко вещество. Плътността се измерва в кг / m³, г / смз, т / m³. Плътността на бирата от леки и други алкохолни напитки може да се види на уебсайт. Това е 1025.0 кг / m³.
- От формула плътност р \u003d т / об \u003d\u003e т \u003d р * о: m³ \u003d 1025.0 кг / m³ * 2 m³ \u003d 2050 кг.
Цевта обем от 200 литра, изцяло напълнени с лека бира, ще има много от 2050 кг.
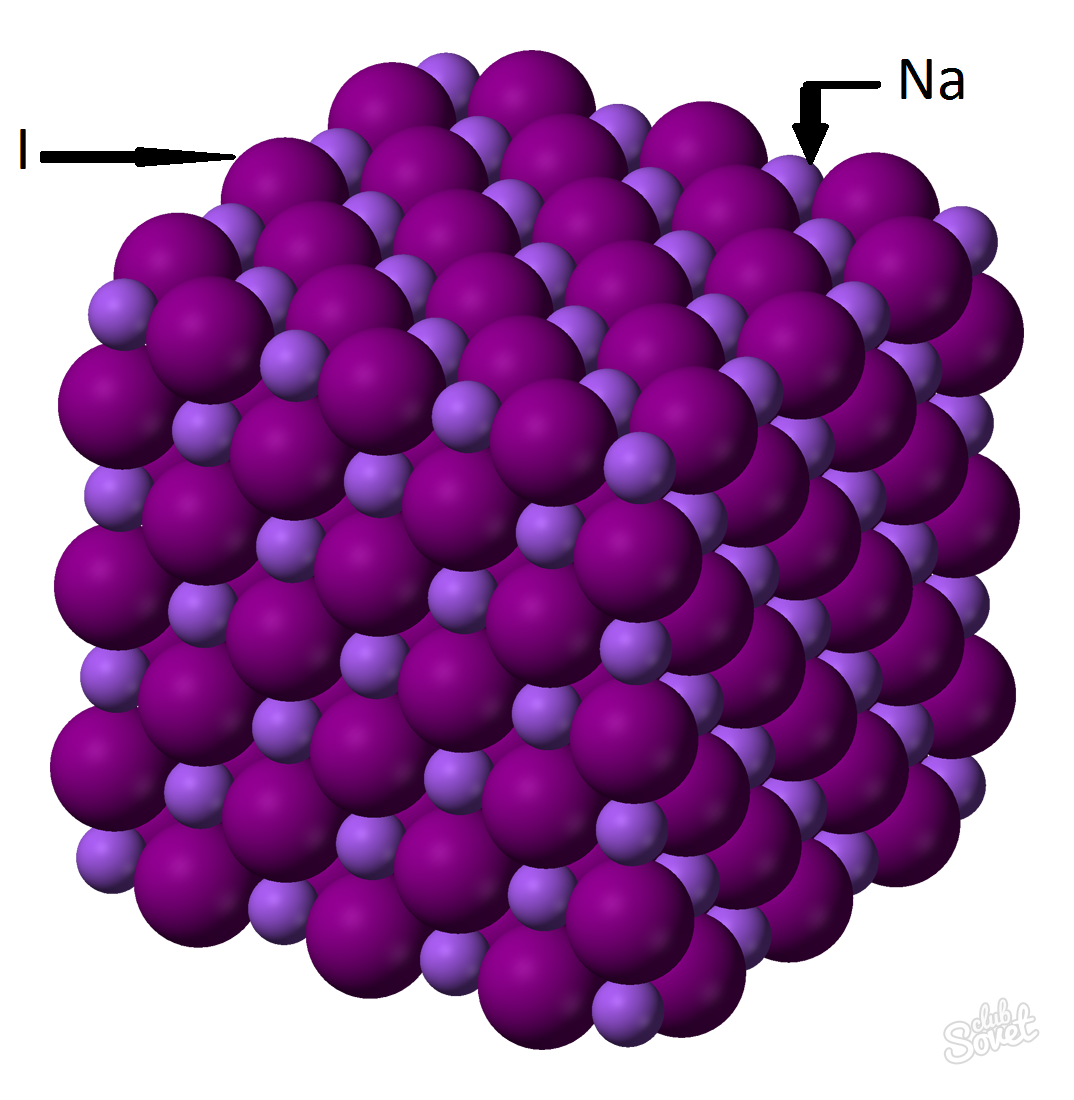
- Моларната маса се изчислява в единична измервателна система S и се измерва в kg / mol, g / mol. Моларната маса на натриев йодид е сумата от моларните маси от всеки елемент: m (Nai) \u003d m (Na) + m (I). Стойността на моларната маса на всеки елемент може да бъде изчислена на масата и можете с помощта на онлайн калкулатор уебсайт: M (nai) \u003d m (na) + m (i) \u003d 23 + 127 \u003d 150 (g / mol).
- От общата формула m (nai) \u003d m (nai) / v (nai) \u003d\u003e m (nai) \u003d v (nai) * m (nai) \u003d 0.6 mol * 150 g / mol \u003d 90 грама.
Натриевата йодидна маса (Nai) с масова фракция на вещество от 0.6 mol е 90 грама.
- Разреждане с воден разтвор. Масата на разтвореното X вещество не променя m (x) \u003d m '(x). Масата на разтвора се увеличава върху масата на добавената вода m '\u003d m (p) + m (h 2О).
- Изпаряване на водата от разтвор. Масата на разтвореното вещество X не променя m (x) \u003d m '(x). Масата на разтвора намалява до масата на изпаряването на водата m '(p) \u003d m (p) -M (h 2О).
- Два решения. Масови разтвори, както и масата на разтвореното вещество X, сместа се сгъва: m '' (x) \u003d m (x) + m '(x). m '' (p) \u003d m (p) + m '(p).
- Загуба на кристали. Масите на разтвореното вещество X и разтворът намаляват върху масата на кристалите, отпаднали: m '(x) \u003d m (х) -М (утайка), m' (р) \u003d m (р) -м (утайка) .

Възможности за намиране на маса от вещество - несвързан курс на училищно обучение и методите, които са напълно прилагани на практика. Всеки може лесно да намери маса от необходимото вещество, прилагане на горните формули и използване на предложените таблици. За да се улесни задачата, предписват всички реакции, техните коефициенти.