Простір навколо нас заповнюється різними фізичними тілами, які складаються з різних речовин з різними масами. Шкільні курси хімії та фізики, інформування концепції та спосіб пошуку маси матерії, слухав і безпечно забули все, що йшло до школи. Але тим часом теоретичні знання, придбані колись, може знадобитися у самому несподіваному моменту.
Обчислення маси речовини з використанням питомої щільності речовини. Приклад - це бочка для 200 літрів. Вам потрібно заповнити барель будь-якої рідини, скажімо, легке пиво. Як знайти багато заповнених бочок? Використовуючи формулу щільності речовини p \u003d m / V, де p - питома щільність речовини, m - маса, V - зайнятий об'єм, щоб знайти багато повної бочки дуже простий:- Обсяги об'єму - кубічні сантиметри, метри. Тобто, бочка для 200 літрів має об'єм 2 м³.
- Міра специфічної щільності за допомогою таблиць і є постійним значенням для кожної речовини. Щільність вимірюється в кг / м³, г / см³, т / м³. Щільність пива світла та інших алкогольних напоїв можна переглянути веб-сайт. Це 1025,0 кг / м³.
- З формули щільності p \u003d m / v \u003d\u003e m \u003d p * v: m³ \u003d 1025,0 кг / м³ * 2 м³ \u003d 2050 кг.
Обсяг бочки 200 літрів, повністю заповнений легким пивом, буде багато 2050 кг.
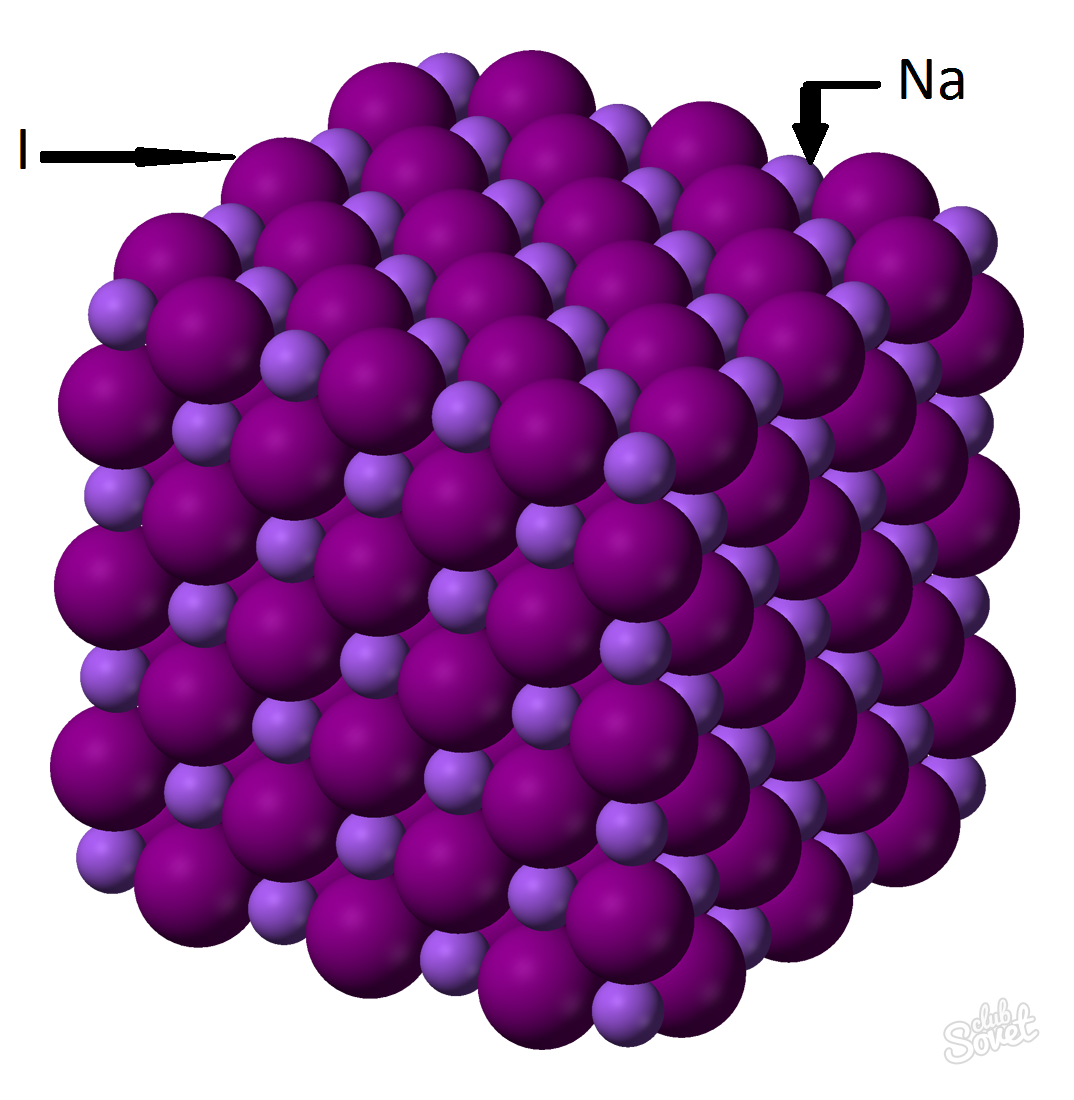
- Молярна маса розраховується в одній вимірювальній системі S і вимірюється в кг / моль, г / моль. Молярна маса йодиду натрію - це сума молярних мас кожного елемента: м (Nai) \u003d M (Na) + m (i). Значення молярної маси кожного елемента може бути розрахована на столі, і ви можете за допомогою онлайн-калькулятора веб-сайт: M (nai) \u003d m (na) + m (i) \u003d 23 + 127 \u003d 150 (г / моль).
- З загальної формули M (Nai) \u003d M (Nai) / V (Nai) \u003d\u003e M (Nai) \u003d V (Nai) * m (Nai) \u003d 0,6 моль * 150 г / моль \u003d 90 грамів.
Іодидну масу натрію (NAI) з масовою часткою речовини 0,6 моль становить 90 грамів.
- Розведення водою. Маса розчиненої х речовини не змінюється m (x) \u003d m '(x). Маса розчину збільшується на масі доданої води m '(p) \u003d m (p) + m (h 2O).
- Випаровування води з розчину. Маса розчиненої речовини X не змінюється m (x) \u003d m '(x). Маса розчину зменшується до маси випаровування води M '(p) \u003d m (p) -m (h 2O).
- Digger два розчини. Масові розчини, а також маса розчиненої речовини X, суміш складається: m '' (x) \u003d m (x) + m '(x). m '' (p) \u003d m (p) + m '(p).
- Втрата кристалів. Маси розчиненої речовини X та зменшення розчину на масу кристалів знизили: m '(x) \u003d m (x) -m (осад), m' (p) \u003d m (p) -m (осад) .

Опції, що знаходять масу речовини - відключений курс навчання шкіл, і методи, повністю застосовані на практиці. Кожен може легко знайти масу необхідної речовини, застосовуючи вищезгадані формули та використовуючи запропоновані таблиці. Для полегшення завдання, призначити всі реакції, їхні коефіцієнти.