Etrafımızdaki boşluk, farklı kütlelere sahip farklı maddelerden oluşan farklı fiziksel cisimler ile doldurulur. Kimya ve fizik okul kursları, konsept ve yöntemi bir madde kütlesi bulma, okula giden her şeyi dinledi ve güvenli bir şekilde unuttum. Ancak bu arada, bir kez edinilen teorik bilgiler en beklenmedik anda ihtiyaç duyulabilir.
Maddenin özel yoğunluğunu kullanarak maddenin kütlesini hesaplamak. Bir örnek - 200 litre için bir namlu var. Herhangi bir sıvının namlusunu doldurmanız gerekir, diyerek, hafif bira. Çok fazla dolu varil nasıl bulabilirsiniz? P \u003d M / V maddesinin yoğunluk formülünün kullanılması, P \u003d M / V maddesinin spesifik yoğunluğu olduğu, M - kitle, v - işgal hacmi, çok fazla tam varil bulmak için çok basittir:- Hacim hacmi - kübik santimetre, metre. Yani, 200 litrenin namlusu 2 m³ hacmine sahiptir.
- Özel yoğunluğun ölçüsü, tabloların yardımıdır ve her madde için sabit bir değerdir. Yoğunluk kg / m³, g / cm³, t / m³ cinsinden ölçülür. Işık ve diğer alkollü içeceklerin yoğunluğu açıkça görülebilir İnternet sitesi. 1025.0 kg / m³.
- Yoğunluk formülünden p \u003d m / v \u003d\u003e m \u003d p * v: m³ \u003d 1025.0 kg / m³ * 2 m³ \u003d 2050 kg.
Tam bir bira ile doldurulmuş 200 litrenin namlu hacmi, 2050 kg'a sahip olacaktır.
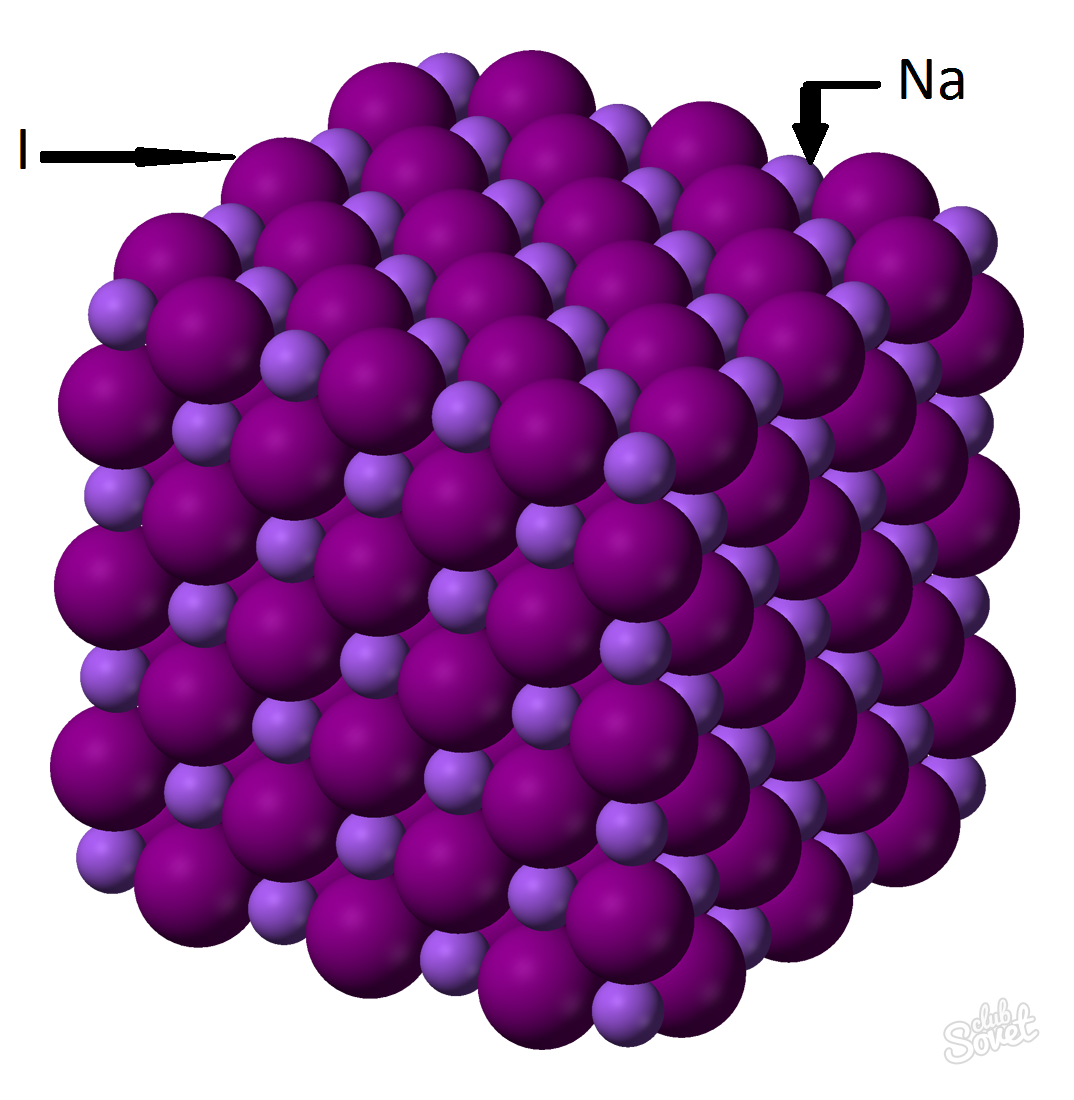
- Molar kütlesi, tek bir ölçüm sisteminde hesaplanır ve kg / mol, g / mol cinsinden ölçülür. Sodyum iyodürün molar kütlesi, her bir elemanın molar kütlelerinin toplamıdır: m (nai) \u003d m (na) + m (i). Her bir elemanın molar kütlesinin değeri masada hesaplanabilir ve çevrimiçi bir hesap makinesinin yardımı ile yapabilirsiniz. İnternet sitesi: M (nai) \u003d m (na) + m (i) \u003d 23 + 127 \u003d 150 (g / mol).
- Genel formülün M (NAI) \u003d M (NAI) / V (NAI) \u003d\u003e M (NAI) \u003d V (NAI) * m (NAI) \u003d 0.6 mol * 150 g / mol \u003d 90 gram.
0.6 mol bir maddenin kütle fraksiyonu olan sodyum iyodür kütlesi (NAI) 90 gramdır.
- Su çözeltisi ile seyreltme. Çözünmüş X maddenin kütlesi M (x) \u003d m '(x) değişmez. Çözeltinin kütlesi, eklenen suyun kütlesinde artar M '(p) \u003d m (p) + m (h 2Ö).
- Çözümden su buharlaşması. Çözünmüş maddenin kütlesi x, m (x) \u003d m '(x) değişmez. Çözeltinin kütlesi, M '(p) \u003d m (p) -m (h'(H)' nın buharlaşması 2Ö).
- Kazıcı iki çözüm. Kitle çözümleri, ayrıca çözünmüş maddenin kütlesinin yanı sıra, karışım katlanır: M '' (x) \u003d m (x) + m '(x). m '' (p) \u003d m (p) + m '(p).
- Kristallerin kaybı. Çözünmüş Madde X'in kütleleri ve çözelti kristallerinin kütlesi düştü: M '(x) \u003d m (x) -m (çökelti), m' (p) \u003d m (p) -m (çökelti) .

Seçenekler Bir maddenin kütlesini bulma - Bağlantı kesilmiş bir okul öğrenimi kursu ve uygulamada tamamen uygulanan yöntemler. Herkes, yukarıdaki formülleri uygulayan ve önerilen tabloları kullanarak herkese kolayca bir kütleyi bulabilir. Görevi kolaylaştırmak için, tüm reaksiyonları, katsayılarını reçete edin.