Ruang di sekitar kita dipenuhi dengan tubuh fisik yang berbeda, yang terdiri dari zat yang berbeda dengan massa yang berbeda. Kursus sekolah kimia dan fisika, menginformasikan konsep dan metode untuk menemukan massa materi, mendengarkan dan dengan aman melupakan segala sesuatu yang bersekolah. Tetapi sementara itu pengetahuan teoretis yang diperoleh dengan sekali mungkin diperlukan pada saat yang paling tidak terduga.
Menghitung massa zat menggunakan kepadatan spesifik zat. Contoh - ada barel untuk 200 liter. Anda perlu mengisi barel cairan, katakanlah, bir ringan. Bagaimana menemukan banyak barel yang diisi? Menggunakan rumus kepadatan zat p \u003d m / v, di mana p adalah kepadatan spesifik zat, m - massa, volume V - ditempati, untuk menemukan banyak barel penuh sangat sederhana:- Volume volume - sentimeter kubik, meter. Artinya, barel untuk 200 liter memiliki volume 2 m³.
- Ukuran kepadatan spesifik adalah dengan bantuan tabel dan merupakan nilai konstan untuk setiap zat. Kepadatan diukur dalam kg / m³, g / cm³, t / m³. Kepadatan bir cahaya dan minuman beralkohol lainnya dapat dilihat situs web. Ini adalah 1025,0 kg / m³.
- Dari rumus kepadatan p \u003d m / v \u003d\u003e m \u003d p * v: m³ \u003d 1025.0 kg / m³ * 2 m³ \u003d 2050 kg.
Volume barel 200 liter, penuh dengan bir ringan, akan memiliki banyak 2050 kg.
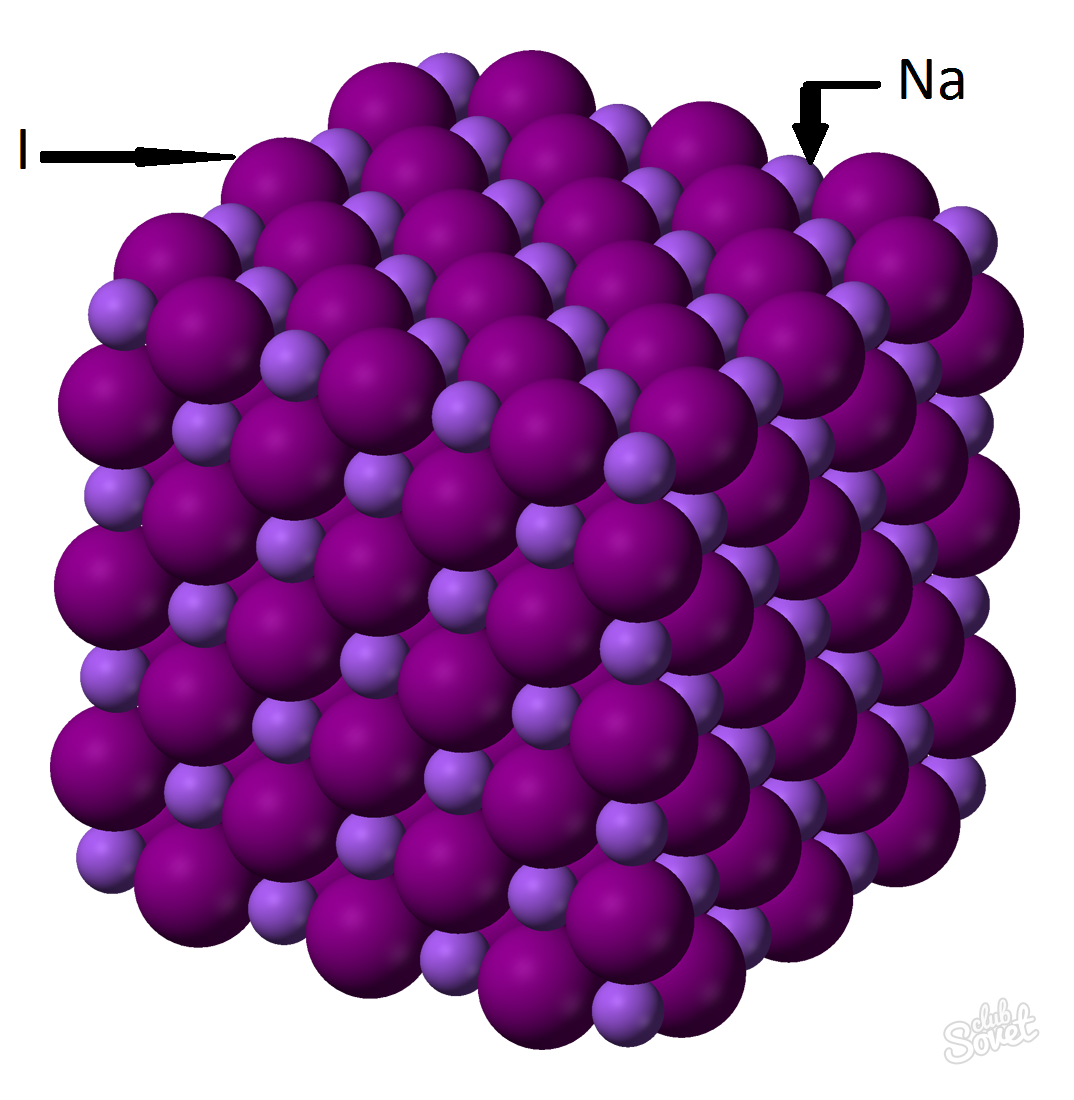
- Massa molar dihitung dalam sistem pengukuran tunggal S dan diukur dalam kg / mol, g / mol. Massa molar natrium iodida adalah jumlah dari massa molar setiap elemen: M (nai) \u003d m (na) + m (i). Nilai massa molar masing-masing elemen dapat dihitung di atas meja, dan Anda dapat dengan bantuan kalkulator online di situs web: M (NAI) \u003d M (Na) + m (i) \u003d 23 + 127 \u003d 150 (g / mol).
- Dari rumus umum M (NAI) \u003d M (NAI) / V (NAI) \u003d\u003e M (NAI) \u003d V (NAI) * M (NAI) \u003d 0,6 mol * 150 g / mol \u003d 90 gram.
Natrium iodida massa (NAI) dengan fraksi massa dari substansi 0,6 mol adalah 90 gram.
- Pengenceran dengan larutan air. Massa zat X terlarut tidak berubah m (x) \u003d m '(x). Massa meningkat solusi pada massa air ditambahkan M '(p) \u003d m (p) + m (H 2HAI).
- penguapan air dari solusi. Massa zat X dilarutkan tidak berubah m (x) \u003d m '(x). Massa dari solusi menurun dengan massa penguapan M air '(p) \u003d m (p) -m (H 2HAI).
- Penggali dua solusi. solusi massa, serta massa zat X dilarutkan, campuran dilipat: M '' (x) \u003d m (x) + m '(x). m '' (p) \u003d m (p) + m '(P).
- Kehilangan kristal. Massa X substansi terlarut dan solusi penurunan pada massa kristal turun: M '(x) \u003d m (x) -m (endapan), M' (p) \u003d m (p) -m (endapan) .

Pilihan Menemukan massa zat - kursus terputus pembelajaran sekolah, dan metode sepenuhnya diterapkan dalam praktek. Setiap orang dapat dengan mudah menemukan massa zat yang diperlukan, menerapkan rumus di atas dan menggunakan tabel yang diusulkan. Untuk memudahkan tugas, meresepkan semua reaksi, koefisien mereka.