A körülöttünk lévő tér különböző fizikai testekkel teli, amely különböző tömegekkel rendelkező különböző anyagokból áll. Iskolai kémia és fizika iskolai kurzusai, tájékoztatva a koncepciót és a módszert, hogy megtalálják az anyag tömegét, meghallgatták és biztonságosan elfelejtették mindent, ami az iskolába ment. Időközben azonban az elméleti tudást megszerzett egyszer szükség lehet a legváratlanabb pillanatban.
Az anyag tömegének kiszámítása az anyag specifikus sűrűségével. Példa - van egy hordó 200 literre. Meg kell töltenie a hordót bármilyen folyadék, mondjuk, könnyű sört. Hogyan találjunk sok töltött hordót? A sűrűség formula az anyag P \u003d M / V, ahol P a fajlagos sűrűsége az anyag, M - tömeg, V - elfoglalt térfogattal, és találni egy csomó teljes hordó nagyon egyszerű:- Térfogatú térfogat - köbméter, méter. Vagyis a 200 liter hordónak van egy térfogata 2 m³.
- A specifikus sűrűség mértéke táblák segítségével történik, és minden egyes anyag számára állandó érték. A sűrűség kg / m³, g / cm3, t / m³-ben mérhető. A fény sűrűsége és más alkoholtartalmú italok megtekinthetők weboldal. Ez 1025,0 kg / m³.
- A sűrűség képletéből p \u003d m / v \u003d\u003e m \u003d p * v: m³ \u003d 1025,0 kg / m³ * 2 m³ \u003d 2050 kg.
A hordó térfogata 200 liter, teljesen tele van könnyű sörrel, sok 2050 kg lesz.
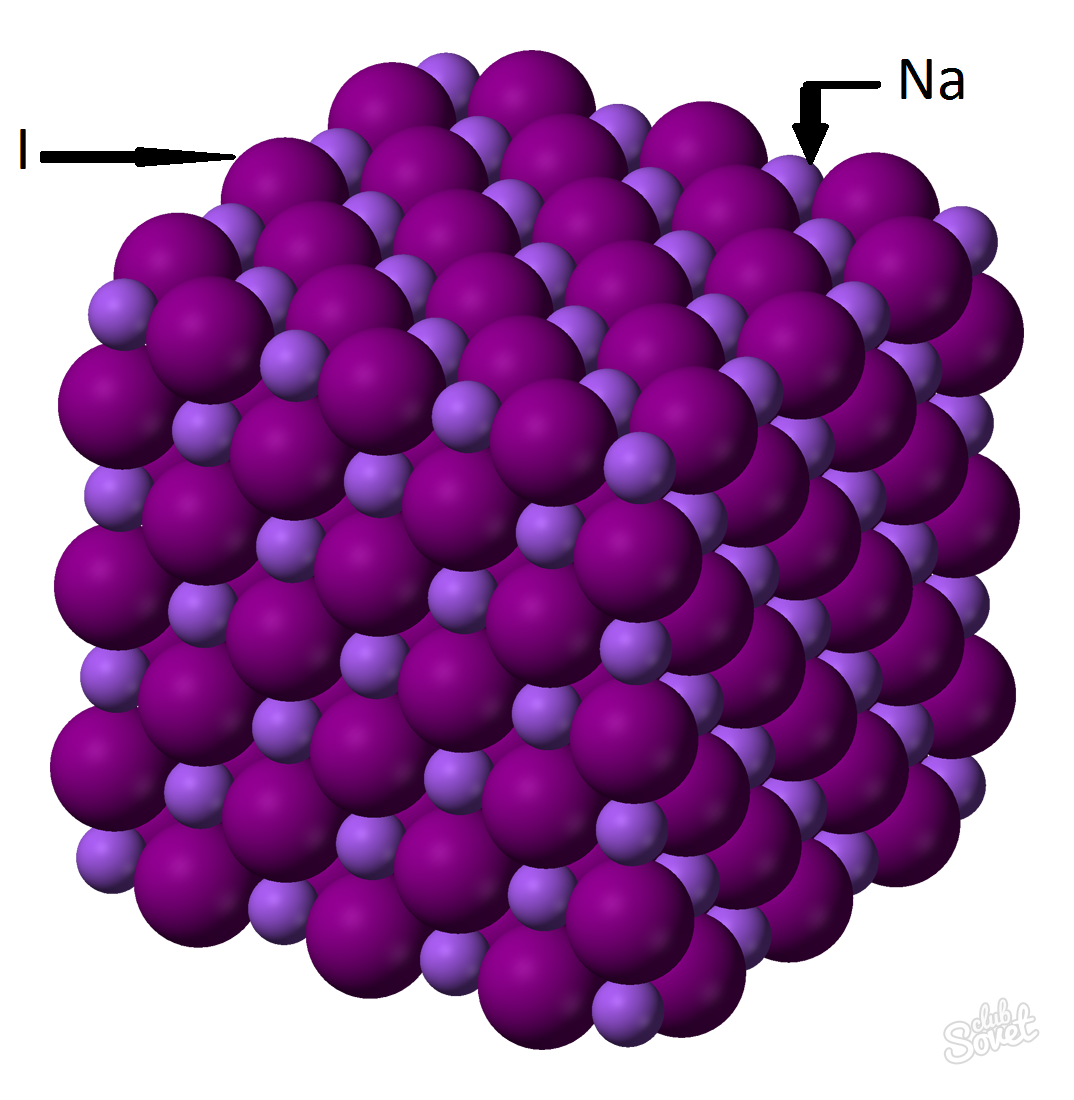
- A moláris tömeget egyetlen mérőrendszerben kell kiszámítani, és kg / mol, g / mol. A nátrium-jodid moláris tömege az egyes elemek moláris tömegeinek összege: m (NAI) \u003d m (Na) + M (I). Az egyes elemek moláris tömegének értékét az asztalon lehet kiszámítani, és az online számológép segítségével lehet weboldal: M (nai) \u003d m (NA) + m (i) \u003d 23 + 127 \u003d 150 (g / mol).
- Az M (NAI) általános képletből \u003d m (NAI) / V (NAI) \u003d\u003e m (NAI) \u003d V (NAI) * m (NAI) \u003d 0,6 mol * 150 g / mol \u003d 90 gramm.
A nátrium-jodid tömege (NAI) 0,6 mol anyag tömegrészével 90 gramm.
- Hígítás vízzel. Az oldott X anyag tömege nem változik m (x) \u003d m '(x). Az oldat tömege növeli a hozzáadott víz tömegét m '(p) \u003d m (p) + m (h 2O).
- Vízbemutatás az oldatból. Az x oldott anyag tömege nem változik m (x) \u003d m '(x). Az oldat tömege csökken a víz m '(p) \u003d m (p) -m (h) 2O).
- Két megoldás. Mass megoldások, valamint a tömege az oldott anyag X, az elegyet van hajtva: M '' (x) \u003d m (x) + m „(x). m '' (p) \u003d m (p) + m '(p).
- Kristályok elvesztése. Az X oldott anyag tömegei és a kristályok tömegének csökkenése csökkent: m '(x) \u003d m (x) -m (csapadék), m' (p) \u003d m (p) -m (p) -m .

Opciók az anyag tömegének megállapítása - az iskolai tanulás lejárta és a gyakorlatban teljes mértékben alkalmazott módszerek. Mindenki könnyen megtalálhatja a szükséges anyag tömegét, a fenti képleteket és a javasolt táblázatok felhasználásával. A feladat megkönnyítése érdekében előírja az összes reakciót, az együtthatókat.