شغل في الفضاء من حولنا مع الهيئات المادية المختلفة، والتي تتكون من مواد مختلفة مع كتل مختلفة. دورات مدرسة الكيمياء والفيزياء، وإبلاغ مفهوم وطريقة ايجاد كتلة المسألة، استمع ونسيت بأمان كل ما درس في المدرسة. ولكن في الوقت نفسه قد تكون هناك حاجة إلى المعرفة النظرية المكتسبة من قبل مرة واحدة في لحظة غير متوقعة.
حساب كتلة المادة باستخدام الكثافة المحددة للمادة. مثال على ذلك - هناك برميل ل 200 لتر. تحتاج إلى ملء برميل أي سائل، كما يقول البيرة الخفيفة. كيف تجد الكثير من البراميل المملوءة؟ باستخدام صيغة الكثافة P \u003d M / V، حيث P هي الكثافة المحددة للمادة، M - كتلة، V - الحجم المحتلة، لإيجاد الكثير من برميل كامل بسيط للغاية:- طرق مجلدات - سم مكعب، متر. وهذا هو، برميل ل 200 لتر لديه حجم من 2 متر مكعب.
- مقياس كثافة محددة هو مع مساعدة من الجداول وهو قيمة ثابتة لكل مادة. يتم قياس الكثافة في KG / M³، G / CM³، T / M³. يمكن عرض كثافة بيرة الضوء وغيرها من المشروبات الكحولية موقع.وبعد ومن 1025.0 كجم / متر مكعب.
- من الصيغة كثافة ع \u003d م / ت \u003d\u003e م \u003d ع * الخامس: متر مكعب \u003d 1025.0 كجم / متر مكعب * 2 متر مكعب \u003d 2050 كجم.
حجم برميل 200 لتر، وليس صحيحا تماما مع البيرة الخفيفة، سيكون له الكثير من 2050 كجم.
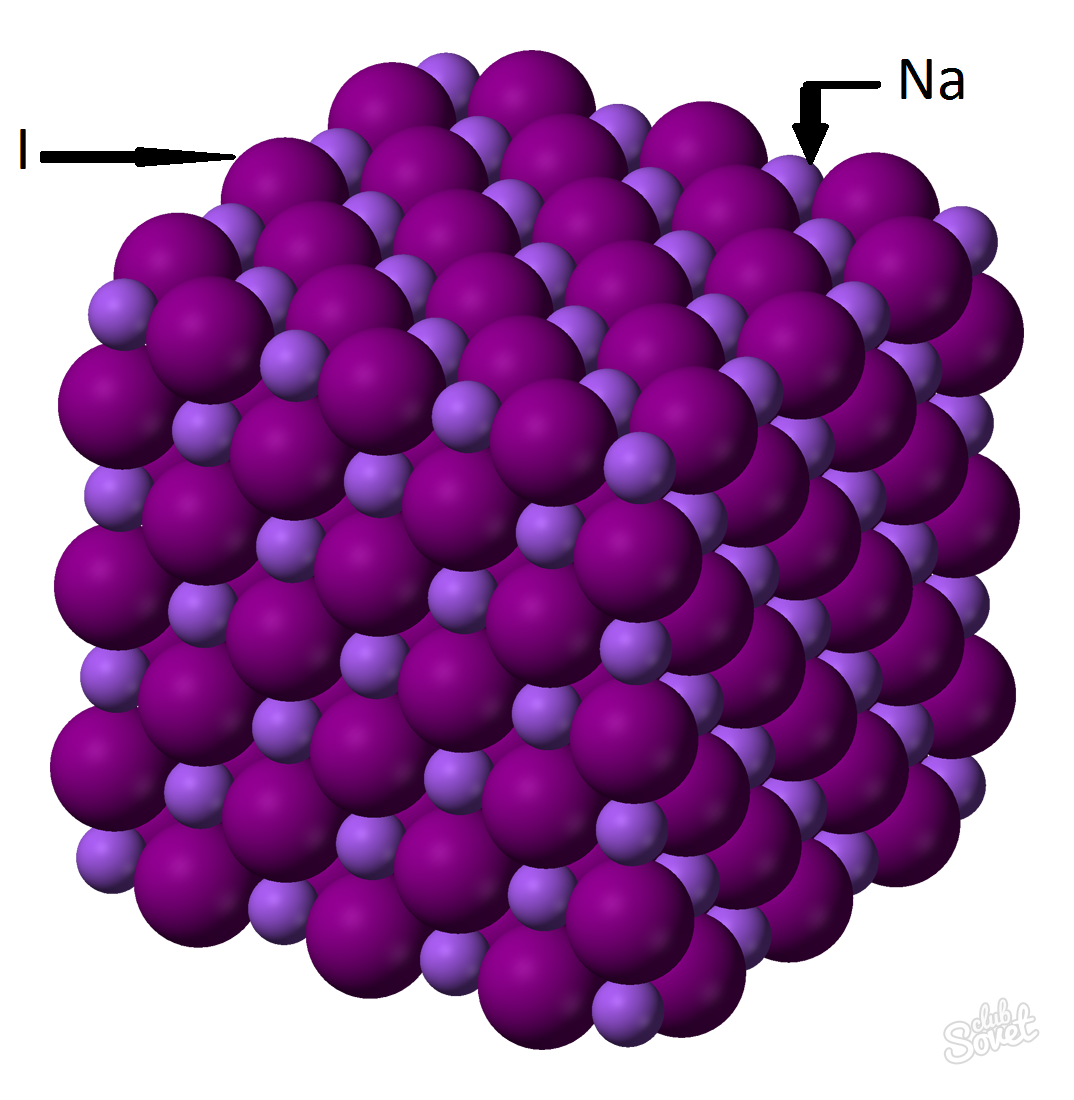
- يتم احتساب كتلة MOLAR في نظام قياس واحد ويقاس في كجم / مول، G / MOL. الكتلة المولية من يوديد الصوديوم هي مجموع الجماهير المولي كل عنصر: M (ناي) \u003d M (نا) + M (ط). ويمكن حساب قيمة الكتلة المولية كل عنصر من الجدول، ويمكن استخدام آلة حاسبة على الانترنت على موقع.: M (nai) \u003d m (na) + m (i) \u003d 23 + 127 \u003d 150 (g / mol).
- من الصيغة العامة M (NAI) \u003d M (NAI) / V (NAI) \u003d\u003e M (NAI) \u003d V (ناي) * M (ناي) \u003d 0.6 مول * 150 غ / مول \u003d 90 غراما.
كتلة اليود الصوديوم (NAI) مع جزء كبير من مادة من 0.6 مول هو 90 غراما.
- تخفيف حل المياه. كتلة المادة المذابة X لا تتغير M (x) \u003d m '(x). كتلة من الزيادات حل على كتلة M المياه المضافة "(ع) \u003d م (ع) + م (H 2س).
- تبخر المياه من الحل. كتلة المادة المذابة X لا تتغير M (x) \u003d m '(x). يتناقص كتلة الحل إلى كتلة تبخر المياه M '(P) \u003d M (P) -M (H 2س).
- حفار حلين. الجماهير من الحلول، وكذلك كتلة مادة س المنحل، ومطوية مع الاختلاط: M '' (س) \u003d م (خ) + م "(خ). m '' (p) \u003d m (p) + m '(p).
- فقدان البلورات. جماهير X مادة المنحل وانخفاض حل لكتلة بلورات انخفضت: M '(س) \u003d م (خ) -m (راسب)، M' (ع) \u003d م (ع) -m (راسب) وبعد

خيارات إيجاد كتلة من مادة - دورة غير متصلة من التعلم المدرسي، والطرق المطبقة بالكامل في الممارسة. يمكن للجميع العثور بسهولة على كتلة من المادة المطلوبة، وتطبيق الصيغ المذكورة أعلاه واستخدام الجداول المقترحة. لتسهيل المهمة، يصف جميع ردود الفعل، معاملاتهم.