Простор око нас је испуњен различитим физичким телима, које се састоје од различитих супстанци са различитим масама. Школски курсеви хемије и физике, информисање концепта и начина проналажења масе материје, слушали су и сигурно заборавили све што је ишло у школу. Али у међувремену, теоријско знање стечено од једном може бити потребно у најнеочекиванијем тренутку.
Израчунавање масе супстанце користећи специфичну густину супстанце. Пример - постоји бачва за 200 литара. Морате да напуните бачву било које течности, реците, лагано пиво. Како пронаћи пуно напуњених бачва? Користећи формулу густине материје П \u003d М / В, где је П специфична густина супстанце, М - масе, В-а заузета количина, да би се пронашао пуно пуне бачве врло једноставно:- Запремине запремине - кубични центиметри, метри. То јест, бачва за 200 литара има запремину од 2 м³.
- Мера специфичне густине је уз помоћ табела и константна је вредност за сваку супстанцу. Густина се мери у кг / м³, г / цм³, т / м³. Густина пива светлости и других алкохолних пића може се погледати на веб сајт. То је 1025,0 кг / м³.
- Од формуле густине п \u003d м / в \u003d\u003e м \u003d п * в: м³ \u003d 1025,0 кг / м³ * 2 м³ \u003d 2050 кг.
Запремина бачве од 200 литара, у потпуности напуњена лаганим пивом, имаће пуно 2050 кг.
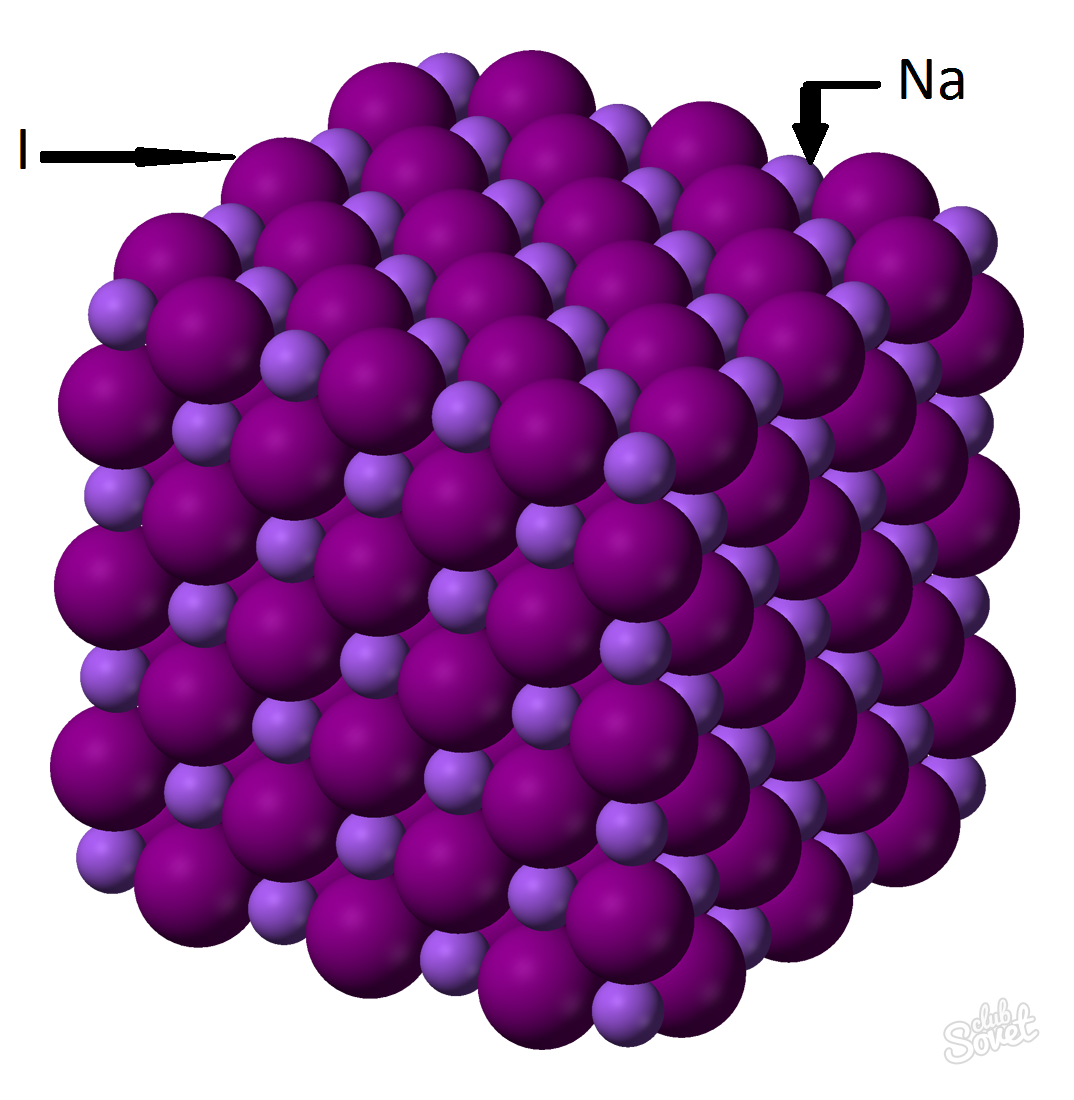
- Моларна маса се израчунава у јединственом мерном систему С и мери се у кг / молу, г / молу. Моларна маса натријум јодида је збир моларних маса сваког елемента: м (наи) \u003d м (на) + м (и). Вредност моларне масе сваког елемента може се израчунати на столу и можете уз помоћ мрежног калкулатора на веб сајт: М (наи) \u003d м (на) + м (и) \u003d 23 + 127 \u003d 150 (г / мол).
- Генералне формуле М (НАИ) \u003d М (НАИ) / В (НАИ) \u003d\u003e м (наи) \u003d В (наи) * м (наи) \u003d 0,6 мол * 150 г / мол \u003d 90 грама.
Натријум јодидна маса (НАИ) са масовним фракцијом неке супстанце од 0,6 мола је 90 грама.
- Разблаживање са водним раствором. Маса раствореног Кс супстанције не мења м (к) \u003d м '(к). Маса раствора расте на маси додате воде М '(п) \u003d м (п) + м (х 2О).
- Испаравање воде од раствора. Маса растворене материје Кс не мења м (к) \u003d м '(к). Маса раствора опада на масу испаравања воде М '(п) \u003d м (п) -м (х 2О).
- Два решења за ископавање. Масовна решења, као и маса растворене материје Кс, смеша је пресавијена: М '' (к) \u003d м (к) + м '(к). м '' (п) \u003d м (п) + м '(п).
- Губитак кристала. Масе растворене супстанце Кс и решење се смањују на маси кристала папучених: м '(к) \u003d м (к) -М (талог), м' (п) \u003d м (п) -М (талог) .

Опције Проналажење масе супстанце - неповезан ток учења у школи и методе у потпуности примењене у пракси. Свако лако може наћи масу потребне супстанце, примењујући горе наведене формуле и користећи предложене таблице. Да бисте олакшали задатак, прописујући све реакције, њихове коефицијенте.