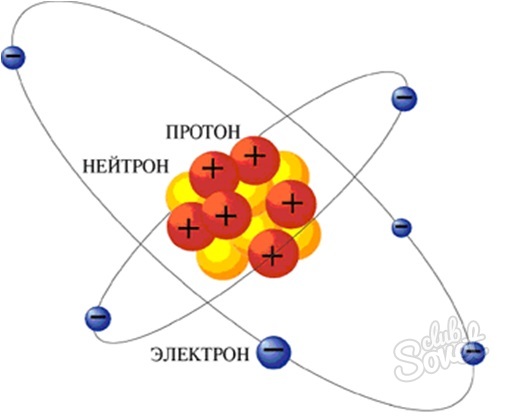
بر اساس درخواست، "چگونه برای پیدا کردن نوترون" به عنوان روش از جستجو برای تعداد نوترون در اتم قابل درک باشد. نوترون یک ذره سنگین می کند که یک بار الکتریکی با پروتون ندارد و با هم هسته اتمی عنصر است. تعداد نوترون در اتم با استفاده از جدول مندلیف تعیین می شود.
چگونه برای پیدا کردن نوترون - ما به دنبال تعداد نوترون ها در اتم
- ما را به جدول مندلیف و پیدا کردن عنصر مورد نظر.
- همانطور که می دانید، عناصر شیمیایی به صورت تصادفی قرار ندارند. شماره توالی مربوط عنصر به تعداد پروتون ها در یک اتم عنصر - عدد اتمی است. در اینجا آن را برای ما ضروری است. این بیشترین تعداد در سلول است، از آن آسان است برای تشخیص، از عناصر تقریبا در (صعودی) هر یک از دیگر دنبال کنید.
- ما به یاد داشته باشید عدد اتمی است.
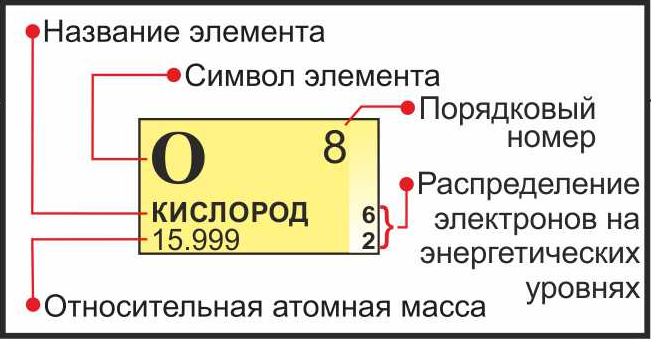
- ما در پیدا کردن جرم اتم. این مقدار در سلول از سیستم تناوبی، که تعداد نوترون های ما به دنبال واقع شده است. به عنوان یک قاعده، جرم در فونت کوچکتر از عدد اتمی ثبت شده، در قالب یک کسر اعشاری. عناصر بیشتر پیچیده درون کروشه.
- برای محاسبات، جرم اتمی است به یک عدد صحیح گرد می شود.
- از آنجا که هسته اتم را شامل نوترون ها و پروتون، و سپس با کم کردن از جرم اتم پروتون (عدد اتمی)، ما قدر از محتوای نوترون ها در اتم از این عنصر به دست آورد.
چگونه برای پیدا کردن نوترون - به عنوان مثال
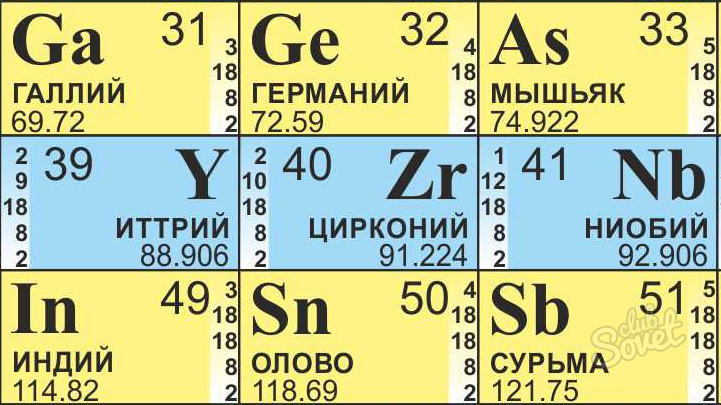
- برای مثال، ما نیاز به پیدا کردن که چگونه بسیاری از نوترون در اتم زیرکونیوم هستند.
- ما در فرمول استفاده می کنیم: نفر متر - n که در آن:
M جرم اتمی است، n تعداد اتم (تعداد پروتون ها) است، N تعداد نوترون است.
- ما zirconiums در جدول مندلیف، آن همیشه باید در دست برای محاسبات شیمیایی باشد.
- جرم اتمی آن 91.22 است، گرد به 91.
- عدد اتمی 40 است.
- ما به دست آوردن که 51 در اتم زیرکونیا است (تعداد \u003d 91-40) نوترون است.
چگونه برای پیدا کردن نوترون - پیدا کردن چند نوترون ایزوتوپ
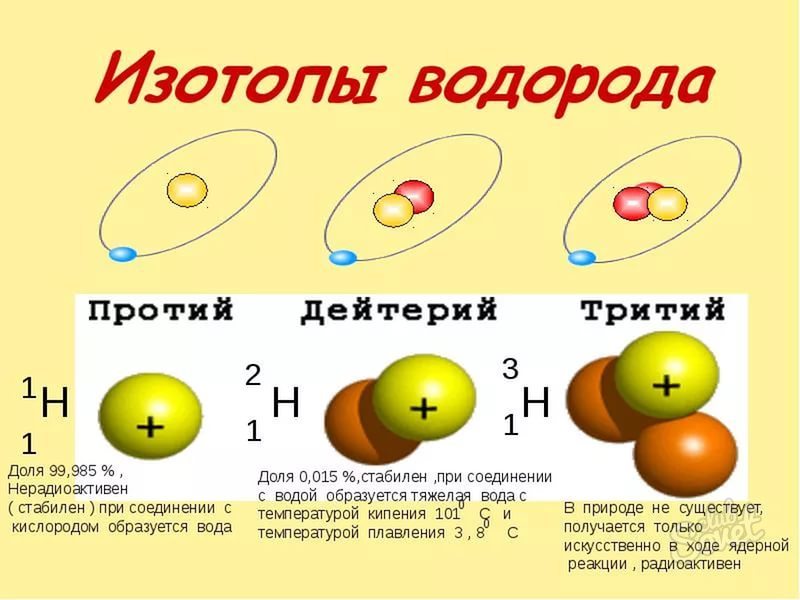
- ایزوتوپها انواع و همان عنصر، اما داشتن یک جرم اتم مختلف. اما عدد اتمی ما به دست به نگاه بالاتر، آنها منطبق است.
- شما باید بدانید که تمام ایزوتوپ های یک عنصر خاص در یک سلول تک در جدول مندلیو قرار می گیرند.
- از آنجا که تعداد اتمی در ایزوتوپ های یک عنصر مشابه هماهنگ است، به این معنی که ما فقط باید توده اتمی را برای محاسبه مقدار نوترون پیدا کنیم.
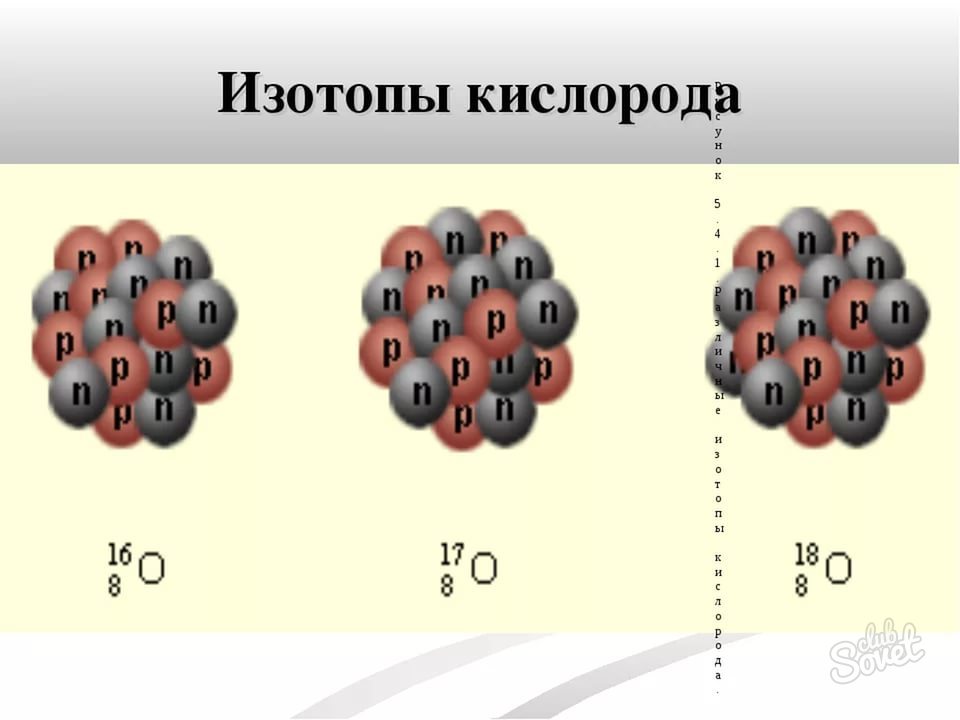
- توده اتمی ایزوتوپ بسیار ساده است - آن را در نام بسیار ایزوتوپ محصور شده است. به عنوان مثال، ایزوتوپ O-16، O-18، ایزوتوپ های اکسیژن O-18 با وزن اتمی 16، 17 و 18 به ترتیب. گاهی اوقات توده اتمی به عنوان شاخص فوقانی به سمت چپ نماد شیمیایی نوشته شده است. عنصر
- بنابراین، ما همه اجزای فرمول را می دانیم. ما محاسبه می کنیم که چگونه بسیاری از نوترون ها در ایزوتوپ هستند.
نحوه پیدا کردن نوترون ها - مثال، ایزوتوپ O-17
- تعداد اتمی تمام ایزوتوپ های اکسیژن، به عنوان عنصر خود 8 است.
- توده اتمی به نام ایزوتوپ نشان داده شده است - برابر با 17 است.
- محاسبه با توجه به فرمول n \u003d m - n، مقدار نوترون ها در اتم ایزوتوپ O-17 9 (17 تا 8) است.
حالا شما می دانید که چگونه تعداد نوترون ها را در اتم هر عنصر و ایزوتوپ محاسبه کنید. البته، برای محاسبات شما همیشه باید یک جدول تناوبی Mendeleev را در دست داشته باشید.