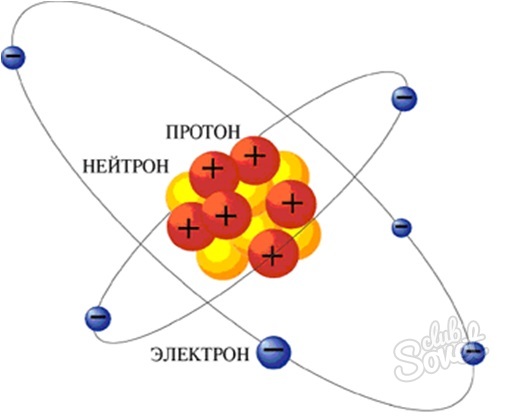
بموجب الطلب، من المفهوم "كيفية العثور على النيوترونات" كطريقة للبحث عن عدد النيوترونات في الذرة. النيوترون هو جسيم ثقيل لا يحتوي على تهمة كهربائية جنبا إلى جنب مع البروتون هو النواة الذرية للعنصر. يتم تحديد عدد النيوترونات في الذرة باستخدام جدول Mendeleev.
كيف تجد النيوترونات - نحن نبحث عن عدد النيوترونات في الذرات
- نأخذ طاولة Mendeleev والعثور على العنصر المطلوب.
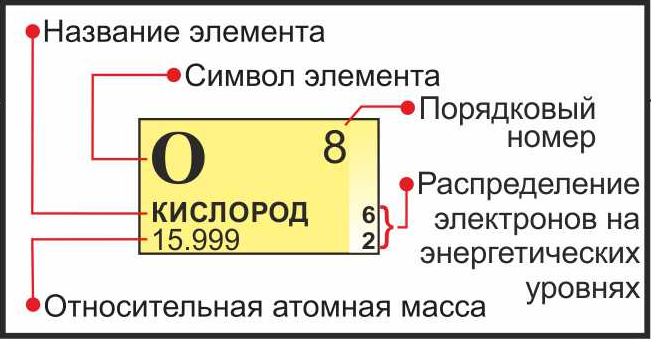
- كما تعلمون، فإن العناصر الكيميائية ليست موجودة عشوائيا. يتوافق عدد التسلسل للعنصر مع عدد البروتونات في عنصر واحد ذرة - الرقم الذري. هنا هو ضروري بالنسبة لنا. هذا هو أكبر رقم في الخلية، من السهل اكتشافه، لأن العناصر تتبع بعضها البعض تقريبا (تصاعدي).
- نتذكر الرقم الذري.
- نجد كتلة الذرة. تقع هذه القيمة أيضا في خلية النظام الدوري، والتي عدد النيوترونات التي نبحث عنها. كقاعدة عامة، يتم تسجيل الكتلة في خط أصغر من رقم Atom، في شكل جزء كبير من الكسر العشري. يتم إرفاق العناصر الأكثر تعقيدا بأقواس مربعة.
- للحسابات، يتم تقريب الكتلة الذرية إلى عدد صحيح.
- نظرا لأن جوهر الذرة يتكون من النيوترونات والبروتونات، إذن من خلال طرح كتلة من كتلة البروتون (الرقم الذري)، نحصل على حجم المحتوى النيوتروني في ذرة هذا العنصر.
كيفية البحث عن النيوترونات - مثال
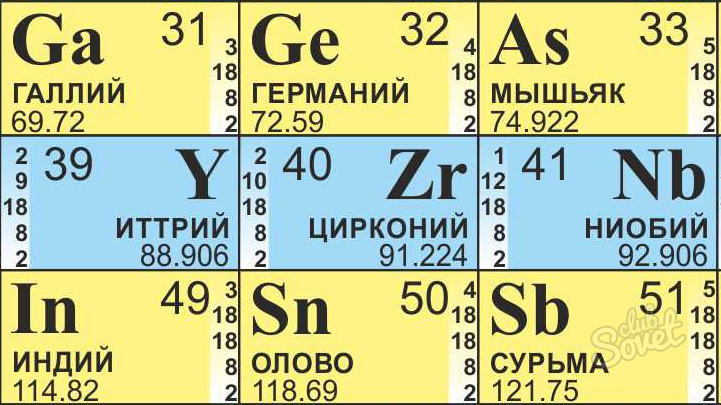
- على سبيل المثال، نحتاج إلى العثور على عدد النيوترونات في ذرية الزرادونيوم.
- سوف نستخدم الصيغة: N \u003d M - N، حيث:
م هي الكتلة الذرية، N هي الرقم الذري (عدد البروتونات)، N هو عدد النيوترونات.
- نجد الزركونيوم في طاولة Mendeleev، يجب أن تكون دائما في متناول اليد للحسابات الكيميائية.
- كتلة ذرطية لها 91.22، تقريب إلى 91.
- الرقم الذري 40.
- نحصل على ذلك في Zirconia Atom هو 51 (ن \u003d 91 - 40) النيوترون.
كيفية البحث عن النيوترونات - ابحث عن عدد النيوترونات التي تحتوي على نظائرها
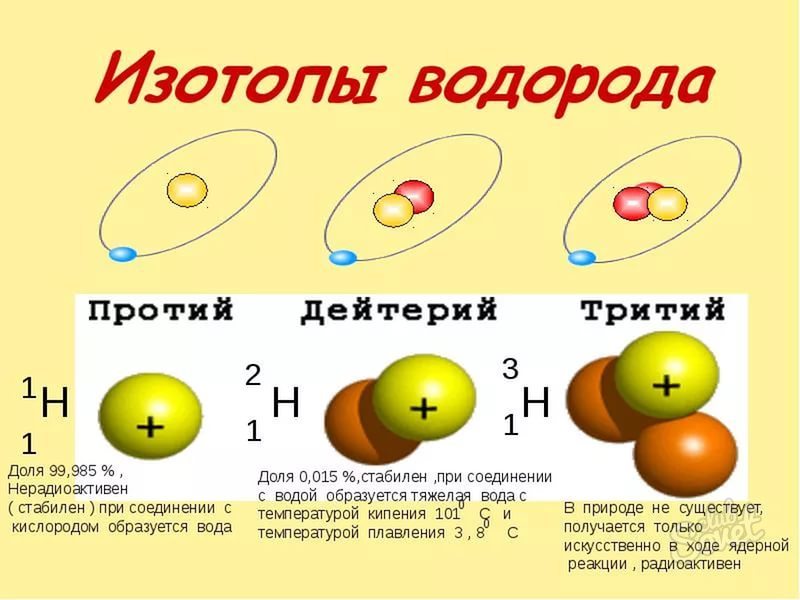
- النظائر هي مجموعة متنوعة من العناصر ونفس العنصر، ولكن وجود كتلة مختلفة من الذرات. لكن الرقم الذري تعلمنا أن ننظر إلى أعلى، فإنهم يتزامنون.
- تحتاج إلى معرفة أن جميع نظائر عنصر معين يتم وضعها في خلية واحدة في جدول Mendeleev.
- نظرا لأن الرقم الذري في نظائر نفس العنصر يتزامن، مما يعني أننا نحتاج فقط إلى العثور على الكتلة الذرية لحساب القيمة النيوترونية.
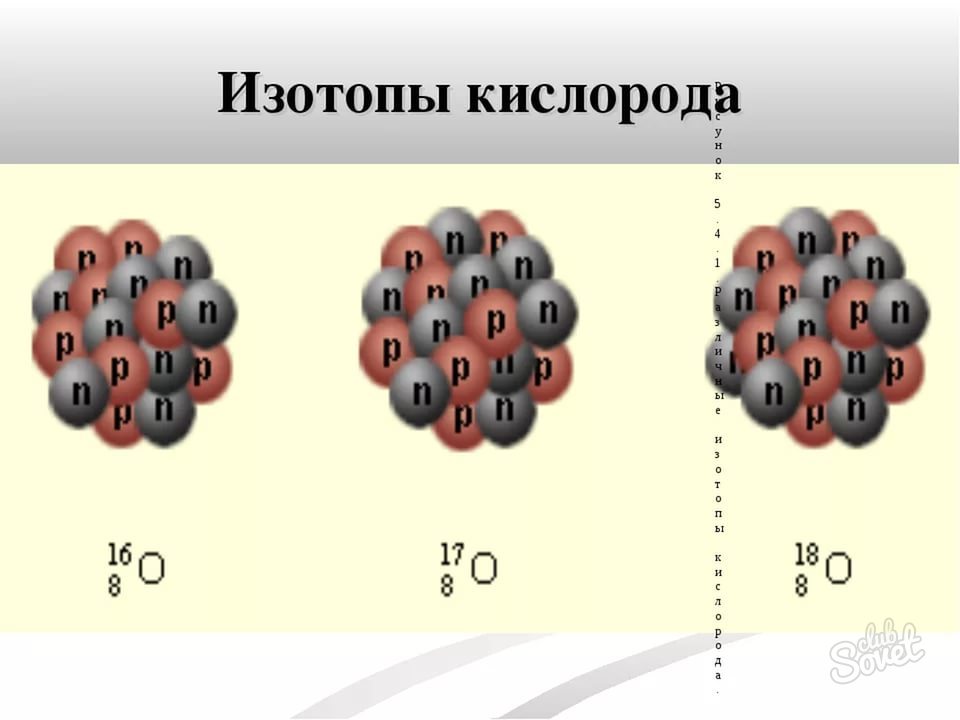
- الكتلة الذرية من النظائر بسيطة للغاية - وهي محاطة بالاسم النظير. على سبيل المثال، O-16، O-17، O-18 النظائر الأكسجين ذات الوزن الذرية 16 و 17 و 18 على التوالي. في بعض الأحيان تكون الكتلة الذرية مكتوبة كمؤشر العلوي إلى يسار الرمز الكيميائي. عنصر.
- وهكذا، نحن نعرف جميع مكونات الصيغة. لن نكون من الصعب حساب عدد النيوترونات في النظائر.
كيف تجد النيوترونات - مثال، Isotope O-17
- العدد الذري لجميع نظائر الأكسجين، حيث أن العنصر نفسه هو 8.
- يشار إلى الكتلة الذرية باسم النظائر - أنها تساوي 17.
- احسب وفقا للصيغة N \u003d M - N، أن كمية النيوترونات في I-17 ISOTOPE ATOM هي 9 (17 - 8).
أنت تعرف الآن كيفية حساب عدد النيوترونات في ذرة أي عنصر ونقاط. بالطبع، بالنسبة للحسابات، ستحتاج دائما إلى الحصول على جدول دوري من Mendeleev في متناول اليد.